Номер 31, страница 9 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
1. Задачи на вычисление количества, массы или объёма продукта реакции, если одно из исходных веществ взято в избытке. Упражнения и задачи для самостоятельного решения - номер 31, страница 9.
№31 (с. 9)
Условие. №31 (с. 9)
скриншот условия

31. Углекислый газ, полученный при полном сгорании 4,48 л метана (н. у.), полностью поглощен 200 г 7%-ного раствора гидроксида натрия. Определите состав полученного раствора (массовые доли веществ).
Решение. №31 (с. 9)


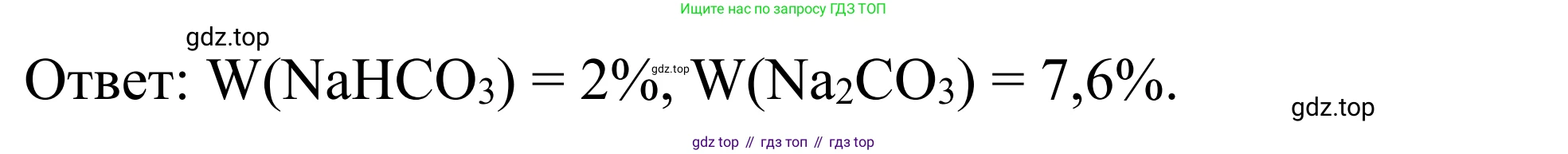
Решение 2. №31 (с. 9)
Дано:
$V(CH_4) = 4,48$ л (н. у.)
$m_{р-ра}(NaOH) = 200$ г
$\omega(NaOH) = 7\%$
Найти:
$\omega(веществ)$ в полученном растворе - ?
Решение:
1. Запишем уравнение реакции полного сгорания метана:
$CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O$
2. Найдем количество вещества метана ($CH_4$), зная его объем при нормальных условиях (н. у.), где молярный объем газа $V_m = 22,4$ л/моль:
$n(CH_4) = \frac{V(CH_4)}{V_m} = \frac{4,48 \text{ л}}{22,4 \text{ л/моль}} = 0,2$ моль
3. По уравнению реакции горения, из 1 моль $CH_4$ образуется 1 моль углекислого газа ($CO_2$). Следовательно, количество вещества $CO_2$ равно количеству вещества $CH_4$:
$n(CO_2) = n(CH_4) = 0,2$ моль
4. Найдем массу образовавшегося углекислого газа. Молярная масса $M(CO_2) = 12 + 2 \cdot 16 = 44$ г/моль:
$m(CO_2) = n(CO_2) \cdot M(CO_2) = 0,2 \text{ моль} \cdot 44 \text{ г/моль} = 8,8$ г
5. Рассчитаем массу и количество вещества гидроксида натрия ($NaOH$) в исходном растворе. Массовая доля $\omega(NaOH) = 7\% = 0,07$.
$m(NaOH) = m_{р-ра}(NaOH) \cdot \omega(NaOH) = 200 \text{ г} \cdot 0,07 = 14$ г
Молярная масса $M(NaOH) = 23 + 16 + 1 = 40$ г/моль:
$n(NaOH) = \frac{m(NaOH)}{M(NaOH)} = \frac{14 \text{ г}}{40 \text{ г/моль}} = 0,35$ моль
6. Углекислый газ ($CO_2$) является кислотным оксидом и реагирует со щелочью ($NaOH$). В зависимости от мольного соотношения реагентов могут образоваться средняя соль (карбонат натрия, $Na_2CO_3$), кислая соль (гидрокарбонат натрия, $NaHCO_3$) или их смесь.
Возможные реакции:
$CO_2 + 2NaOH \rightarrow Na_2CO_3 + H_2O$ (1)
$CO_2 + NaOH \rightarrow NaHCO_3$ (2)
Найдем мольное соотношение щелочи к кислотному оксиду:
$\frac{n(NaOH)}{n(CO_2)} = \frac{0,35 \text{ моль}}{0,2 \text{ моль}} = 1,75$
Поскольку соотношение $1 < 1,75 < 2$, в результате реакции образуется смесь двух солей: карбоната и гидрокарбоната натрия. Оба исходных вещества прореагируют полностью.
7. Для расчета количеств образовавшихся солей можно составить систему уравнений. Пусть в реакцию (1) вступило $x$ моль $CO_2$, а в реакцию (2) – $y$ моль $CO_2$. Тогда:
$\begin{cases} x + y = n(CO_2) = 0,2 \\ 2x + y = n(NaOH) = 0,35 \end{cases}$
Вычитая первое уравнение из второго, получаем:
$(2x+y) - (x+y) = 0,35 - 0,2$
$x = 0,15$ моль
Подставим значение $x$ в первое уравнение:
$0,15 + y = 0,2 \Rightarrow y = 0,05$ моль
Таким образом, в реакции образовалось:
$n(Na_2CO_3) = x = 0,15$ моль
$n(NaHCO_3) = y = 0,05$ моль
8. Найдем массы образовавшихся солей. Молярные массы: $M(Na_2CO_3) = 106$ г/моль, $M(NaHCO_3) = 84$ г/моль.
$m(Na_2CO_3) = n(Na_2CO_3) \cdot M(Na_2CO_3) = 0,15 \text{ моль} \cdot 106 \text{ г/моль} = 15,9$ г
$m(NaHCO_3) = n(NaHCO_3) \cdot M(NaHCO_3) = 0,05 \text{ моль} \cdot 84 \text{ г/моль} = 4,2$ г
9. Определим массу конечного раствора. Она складывается из массы исходного раствора $NaOH$ и массы поглощенного $CO_2$.
$m_{конечн. р-ра} = m_{р-ра}(NaOH) + m(CO_2) = 200 \text{ г} + 8,8 \text{ г} = 208,8$ г
10. Рассчитаем массовые доли веществ в конечном растворе.
Массовая доля карбоната натрия:
$\omega(Na_2CO_3) = \frac{m(Na_2CO_3)}{m_{конечн. р-ра}} = \frac{15,9 \text{ г}}{208,8 \text{ г}} \approx 0,07615 \text{ или } 7,62\%$
Массовая доля гидрокарбоната натрия:
$\omega(NaHCO_3) = \frac{m(NaHCO_3)}{m_{конечн. р-ра}} = \frac{4,2 \text{ г}}{208,8 \text{ г}} \approx 0,02011 \text{ или } 2,01\%$
Оставшаяся часть раствора – вода. Её массовую долю можно найти, вычтя из 100% доли солей:
$\omega(H_2O) = 100\% - 7,62\% - 2,01\% = 90,37\%$
Ответ: Массовая доля карбоната натрия ($Na_2CO_3$) в полученном растворе составляет $7,62\%$; массовая доля гидрокарбоната натрия ($NaHCO_3$) – $2,01\%$; массовая доля воды ($H_2O$) – $90,37\%$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 31 расположенного на странице 9 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №31 (с. 9), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















