Номер 30, страница 9 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
1. Задачи на вычисление количества, массы или объёма продукта реакции, если одно из исходных веществ взято в избытке. Упражнения и задачи для самостоятельного решения - номер 30, страница 9.
№30 (с. 9)
Условие. №30 (с. 9)
скриншот условия

30. Через 350 г 10%-ного раствора гидроксида натрия пропустили 11,2 л сероводорода (н. у.). Рассчитайте массу воды в полученном растворе.
Решение. №30 (с. 9)

Решение 2. №30 (с. 9)
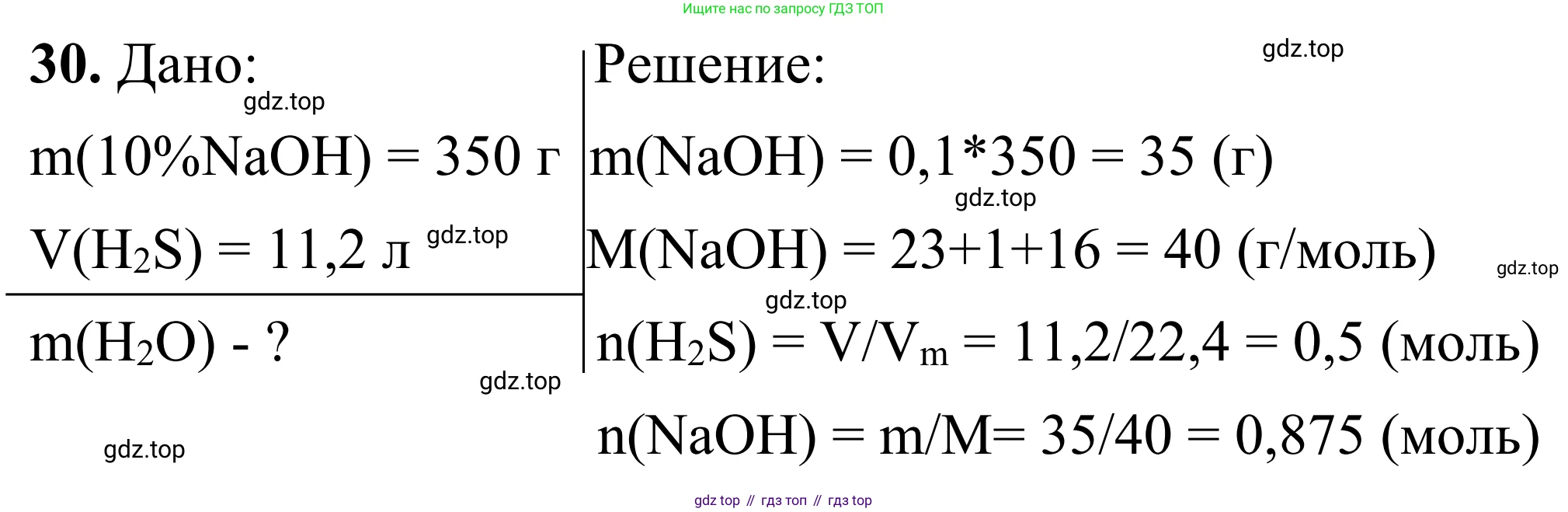
Дано:
Масса раствора гидроксида натрия, $m(р-ра~NaOH) = 350~г$
Массовая доля гидроксида натрия, $ω(NaOH) = 10\% = 0,1$
Объем сероводорода, $V(H_2S) = 11,2~л$ (н. у.)
Найти:
Массу воды в полученном растворе, $m_{конечн}(H_2O) - ?$
Решение:
1. Найдем массу и количество вещества гидроксида натрия в исходном растворе.
Масса чистого гидроксида натрия:
$m(NaOH) = m(р-ра~NaOH) \cdot ω(NaOH) = 350~г \cdot 0,1 = 35~г$
Молярная масса гидроксида натрия:
$M(NaOH) = 23 + 16 + 1 = 40~г/моль$
Количество вещества гидроксида натрия:
$n(NaOH) = \frac{m(NaOH)}{M(NaOH)} = \frac{35~г}{40~г/моль} = 0,875~моль$
2. Найдем массу воды в исходном растворе.
$m_{исх}(H_2O) = m(р-ра~NaOH) - m(NaOH) = 350~г - 35~г = 315~г$
3. Найдем количество вещества сероводорода. Так как объем дан при нормальных условиях (н. у.), используем молярный объем газа $V_m = 22,4~л/моль$.
$n(H_2S) = \frac{V(H_2S)}{V_m} = \frac{11,2~л}{22,4~л/моль} = 0,5~моль$
4. Определим, какие продукты образуются в результате реакции. Сероводород - двухосновная кислота, поэтому реакция с щелочью может идти с образованием кислой или средней соли:
$H_2S + NaOH \rightarrow NaHS + H_2O$ (соотношение реагентов 1:1)
$H_2S + 2NaOH \rightarrow Na_2S + 2H_2O$ (соотношение реагентов 1:2)
Сравним соотношение количеств реагентов в задаче:
$\frac{n(NaOH)}{n(H_2S)} = \frac{0,875~моль}{0,5~моль} = 1,75$
Поскольку соотношение $1 < 1,75 < 2$, гидроксид натрия находится в избытке для образования только кислой соли, но в недостатке для полного превращения в среднюю соль. Это означает, что в реакцию вступят все исходные вещества, и в растворе образуется смесь двух солей: гидросульфида натрия $NaHS$ и сульфида натрия $Na_2S$.
5. Рассчитаем количество вещества воды, образовавшейся в реакции. В обеих реакциях количество моль образующейся воды равно количеству моль прореагировавшей щелочи. Так как весь гидроксид натрия вступает в реакцию, то:
$n_{обр}(H_2O) = n(NaOH) = 0,875~моль$
6. Найдем массу воды, образовавшейся в ходе реакции.
Молярная масса воды:
$M(H_2O) = 2 \cdot 1 + 16 = 18~г/моль$
Масса образовавшейся воды:
$m_{обр}(H_2O) = n_{обр}(H_2O) \cdot M(H_2O) = 0,875~моль \cdot 18~г/моль = 15,75~г$
7. Найдем общую массу воды в конечном растворе. Она равна сумме массы воды в исходном растворе и массы воды, образовавшейся в реакции.
$m_{конечн}(H_2O) = m_{исх}(H_2O) + m_{обр}(H_2O) = 315~г + 15,75~г = 330,75~г$
Ответ: масса воды в полученном растворе составляет 330,75 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 30 расположенного на странице 9 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №30 (с. 9), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















