История развития физики, страница 186 - гдз по физике 10 класс учебник Хижнякова, Синявина

Авторы: Хижнякова Л. С., Синявина А. А., Холина С. А., Кудрявцев В. В.
Тип: Учебник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Уровень обучения: базовый и углублённый
Цвет обложки: фиолетовый изображены парашютисты
ISBN: 978-5-360-09924-6
Популярные ГДЗ в 10 классе
Молекулярная физика. Глава 7. Методы изучения тепловых явлений. Температура. Параграф 33. Основные положения молекулярно-кинетической теории. Вопросы - страница 186.
История развития физики (с. 186)
Условие. История развития физики (с. 186)
скриншот условия

Из истории развития физики
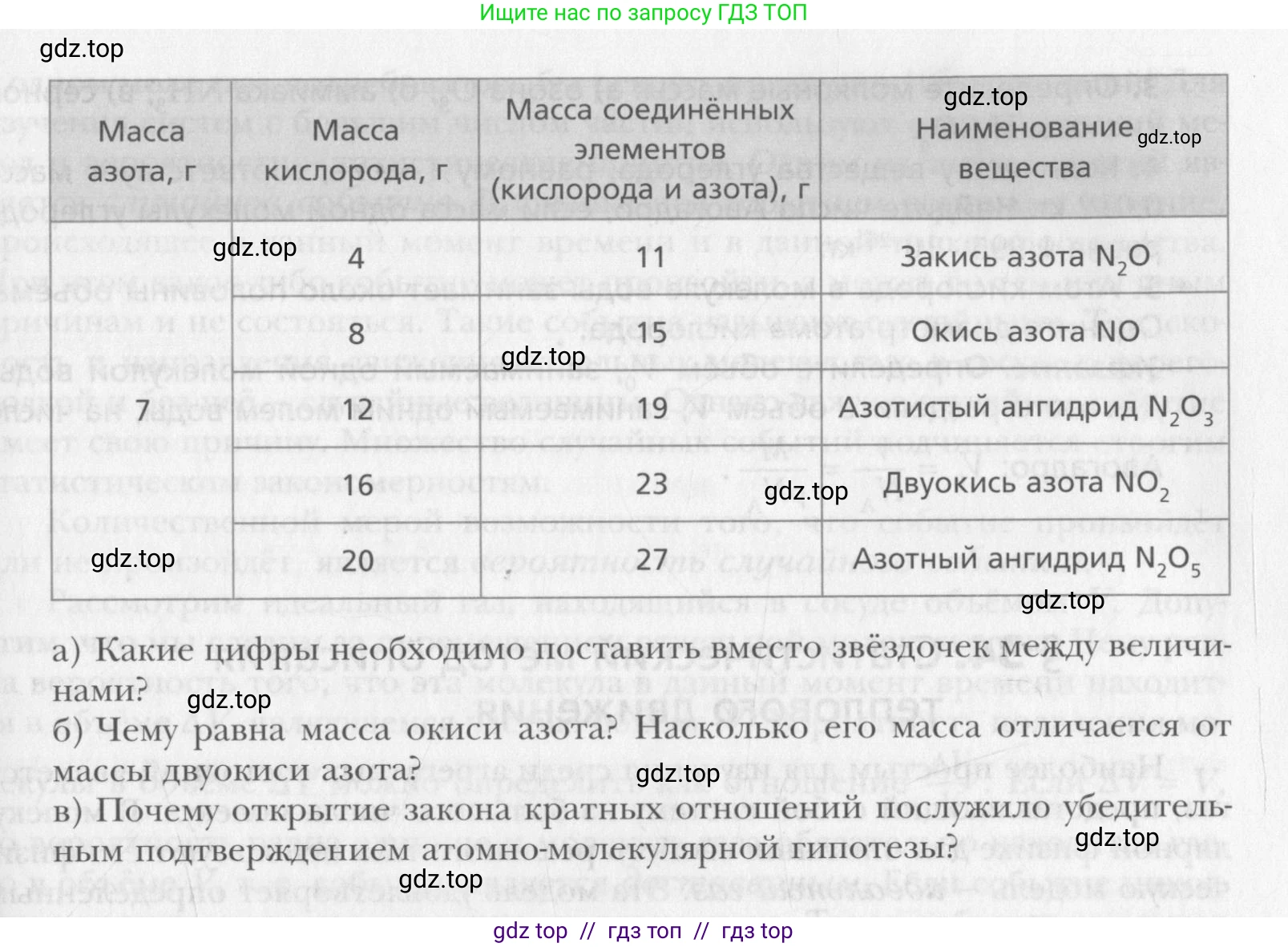
Косвенное доказательство того, что все вещества состоят из молекул, было дано английским химиком Джоном Дальтоном (1766–1844). Он установил закон кратных отношений (1803). Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого элемента, соотносятся между собой как небольшие целые числа. В таблице представлены массы элементов азота и кислорода, вступивших в химические соединения. Массы кислорода, приходящиеся на одну и ту же массу азота (7 г), в этих соединениях относят-ся как $4 : 8 : * : 16 : * = 1 : * : * : * : 5$.
Масса азота, г Масса кислорода, г Масса соединённых элементов (кислорода и азота), г Наименование вещества
4 11 Закись азота $N_2O$
8 15 Окись азота $NO$
7 12 19 Азотистый ангидрид $N_2O_3$
16 23 Двуокись азота $NO_2$
20 27 Азотный ангидрид $N_2O_5$
а) Какие цифры необходимо поставить вместо звёздочек между величинами?
б) Чему равна масса окиси азота? Насколько его масса отличается от массы двуокиси азота?
в) Почему открытие закона кратных отношений послужило убедительным подтверждением атомно-молекулярной гипотезы?
Решение. История развития физики (с. 186)
а) В тексте задачи приведено соотношение масс кислорода, приходящихся на одну и ту же массу азота (7 г), в различных химических соединениях. Из таблицы можно определить эти массы для всех пяти оксидов азота:
Для закиси азота (N₂O): 4 г кислорода.
Для окиси азота (NO): 8 г кислорода.
Для азотистого ангидрида (N₂O₃): 12 г кислорода.
Для двуокиси азота (NO₂): 16 г кислорода.
Для азотного ангидрида (N₂O₅): 20 г кислорода.
Таким образом, ряд масс кислорода выглядит так: 4, 8, 12, 16, 20.
Первое соотношение, указанное в тексте, это $4 : 8 : * : 16 : *$. Вместо звёздочек нужно подставить недостающие значения из нашего ряда, а именно 12 и 20. Получаем соотношение $4 : 8 : 12 : 16 : 20$.
Второе соотношение является упрощённой формой первого: $1 : * : * : * : 5$. Оно получается делением всех членов первого соотношения на наименьшее число, то есть на 4:
$4 / 4 = 1$
$8 / 4 = 2$
$12 / 4 = 3$
$16 / 4 = 4$
$20 / 4 = 5$
Таким образом, вместо звёздочек во втором соотношении нужно поставить цифры 2, 3 и 4. Получаем соотношение $1 : 2 : 3 : 4 : 5$.
Ответ: В первом соотношении ($4 : 8 : * : 16 : *$) вместо звёздочек необходимо поставить числа 12 и 20. Во втором соотношении ($1 : * : * : * : 5$) вместо звёздочек необходимо поставить цифры 2, 3 и 4.
б)
Дано:
Масса окиси азота (из таблицы) $m_{NO} = 15 \text{ г}$
Масса двуокиси азота (из таблицы) $m_{NO_2} = 23 \text{ г}$
В системе СИ:
$m_{NO} = 0.015 \text{ кг}$
$m_{NO_2} = 0.023 \text{ кг}$
Найти:
Массу окиси азота $m_{NO} - ?$
Разницу масс $\Delta m = m_{NO_2} - m_{NO} - ?$
Решение:
1. Масса окиси азота (NO) указана в таблице в столбце «Масса соединённых элементов» и равна 15 г.
2. Масса двуокиси азота (NO₂) указана в той же колонке и равна 23 г.
3. Найдём разницу между их массами:
$\Delta m = m_{NO_2} - m_{NO} = 23 \text{ г} - 15 \text{ г} = 8 \text{ г}$
В системе СИ:
$\Delta m = 0.023 \text{ кг} - 0.015 \text{ кг} = 0.008 \text{ кг}$
Ответ: Масса окиси азота равна 15 г. Её масса отличается от массы двуокиси азота на 8 г (масса двуокиси азота больше).
в) Открытие закона кратных отношений стало убедительным подтверждением атомно-молекулярной гипотезы по следующей причине. Этот закон, установленный экспериментально, гласит, что если два элемента образуют несколько соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа.
Такое целочисленное соотношение масс можно объяснить, только если предположить, что вещество состоит из дискретных частиц — атомов, которые имеют постоянную массу и соединяются друг с другом в определённых, целочисленных пропорциях, образуя молекулы. Например, в оксидах азота на одно и то же число атомов азота (что соответствует фиксированной массе азота) приходится разное, но всегда целое число атомов кислорода (1, 2, 3, 4, 5). Поскольку все атомы кислорода имеют одинаковую массу, то и общие массы кислорода, вступающие в реакцию, будут относиться как целые числа ($1:2:3:4:5$).
Если бы вещество было непрерывным (делимым до бесконечности), а не состояло из атомов, то элементы могли бы соединяться в любых, не обязательно целочисленных, соотношениях. Таким образом, закон кратных отношений является прямым следствием дискретного, атомного строения вещества.
Ответ: Закон кратных отношений показал, что элементы соединяются в простых целочисленных соотношениях по массе, что напрямую указывает на то, что вещество состоит из дискретных частиц (атомов), соединяющихся в виде целых единиц для образования молекул. Это стало мощным аргументом в пользу атомно-молекулярной гипотезы.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по физике за 10 класс, для упражнения История развития физики расположенного на странице 186 к учебнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по физике к упражнению История развития физики (с. 186), авторов: Хижнякова (Людмила Степановна), Синявина (Анна Афанасьевна), Холина (Светлана Александровна), Кудрявцев (Василий Владимирович), базовый и углублённый уровень обучения учебного пособия издательства Вентана-граф.



















