Номер 66, страница 93 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 3. Кислородсодержащие органические соединения. 3.1. Спирты и фенолы. Уровень 2 - номер 66, страница 93.
№66 (с. 93)
Условие. №66 (с. 93)
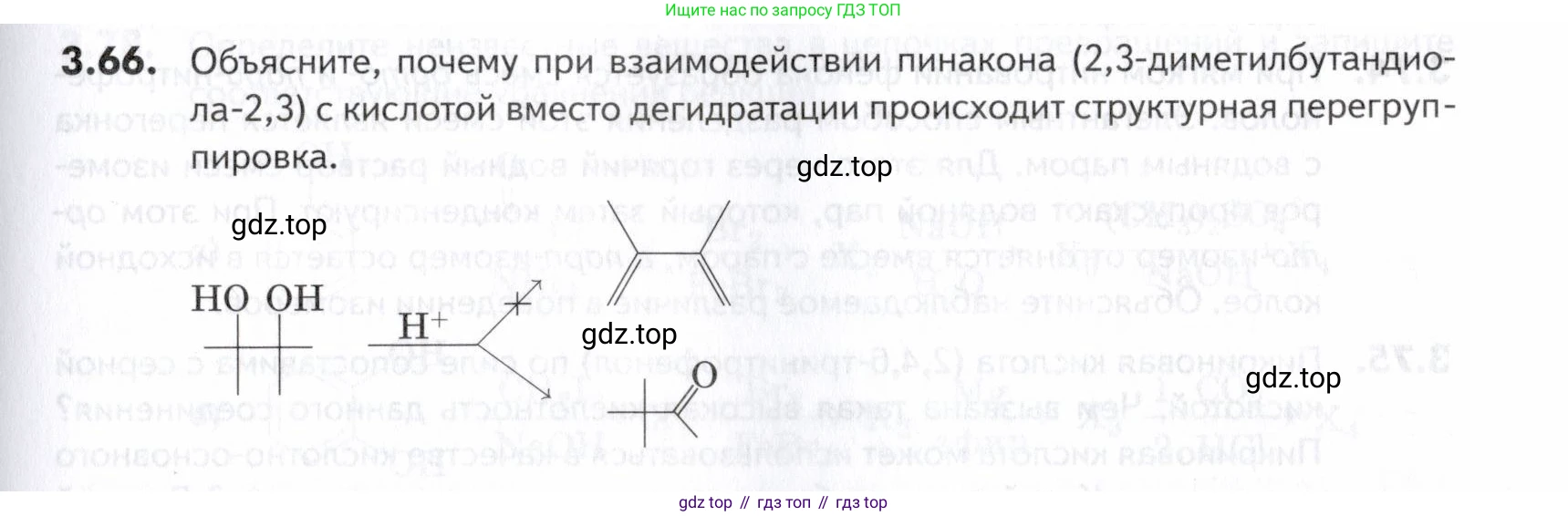
3.66. Объясните, почему при взаимодействии пинакона (2,3-диметилбутандиола-2,3) с кислотой вместо дегидратации происходит структурная перегруппировка.
Решение 3. №66 (с. 93)
Решение
Взаимодействие пинакона (2,3-диметилбутандиола-2,3) с кислотой в качестве катализатора представляет собой классический пример молекулярной перегруппировки, известной как пинаколиновая перегруппировка. Причина, по которой происходит структурная перегруппировка с образованием кетона (пинаколона) вместо дегидратации с образованием диена, заключается в большей энергетической выгодности промежуточных стадий, ведущих к перегруппировке.
Механизм реакции можно разбить на несколько стадий:
1. Протонирование гидроксильной группы.
В кислой среде протон ($H^+$) присоединяется к атому кислорода одной из гидроксильных групп пинакона. В результате образуется оксониевый ион. Это превращает гидроксильную группу ($-OH$), которая является плохой уходящей группой, в хорошую уходящую группу ($-OH_2^+$), представляющую собой молекулу воды.
$(CH_3)_2C(OH)-C(OH)(CH_3)_2 + H^+ \rightleftharpoons (CH_3)_2C(OH)-C(OH_2^+)(CH_3)_2$
2. Отщепление воды и образование карбокатиона.
Протонированная гидроксильная группа отщепляется в виде молекулы воды. Это приводит к образованию третичного карбокатиона, который является относительно стабильным благодаря индуктивному эффекту и гиперконьюгации с соседними алкильными группами.
$(CH_3)_2C(OH)-C(OH_2^+)(CH_3)_2 \rightarrow (CH_3)_2C(OH)-C^+(CH_3)_2 + H_2O$
3. Перегруппировка (1,2-метильный сдвиг).
Это ключевая стадия, определяющая исход реакции. Вместо того чтобы отщепить протон от соседнего атома углерода для образования двойной связи (что привело бы к продукту дегидратации), происходит миграция одной из метильных групп ($CH_3$) от соседнего атома углерода к положительно заряженному атому (так называемый 1,2-сдвиг).
Движущей силой этой перегруппировки является образование значительно более стабильного промежуточного соединения. После миграции метильной группы положительный заряд оказывается на атоме углерода, связанном с оставшейся гидроксильной группой. Этот новый катион стабилизирован за счет резонанса с неподеленной электронной парой атома кислорода. В результате образуется резонансно-стабилизированный ион (протонированный кетон), в котором все "тяжелые" атомы (углерод и кислород) имеют завершенную электронную оболочку (октет), что делает его намного стабильнее исходного третичного карбокатиона.
$(CH_3)_2C(OH)-C^+(CH_3)_2 \rightarrow (CH_3)_3C-C^+(OH)CH_3 \leftrightarrow (CH_3)_3C-C(=O^+H)CH_3$
4. Депротонирование.
На последней стадии молекула воды (выступающая в роли основания) отщепляет протон от положительно заряженного атома кислорода. В результате образуется конечный продукт — кетон пинаколон (3,3-диметилбутан-2-он) и регенерируется кислотный катализатор ($H_3O^+$).
$(CH_3)_3C-C(=O^+H)CH_3 + H_2O \rightarrow (CH_3)_3C-C(=O)CH_3 + H_3O^+$
Почему перегруппировка предпочтительнее дегидратации?
Альтернативный путь для третичного карбокатиона, образовавшегося на стадии 2, — это реакция элиминирования (отщепления протона от соседней метильной группы). Это привело бы к образованию ненасыщенного спирта (2,3-диметилбут-3-ен-2-ола). Дальнейшая дегидратация этого спирта (второй акт дегидратации) могла бы привести к диену (2,3-диметилбута-1,3-диену), показанному на схеме в условии.
Однако путь перегруппировки является энергетически более выгодным. Переход от третичного карбокатиона к резонансно-стабилизированному протонированному кетону (стадия 3) сопровождается значительным выигрышем в энергии. Стабильность этого интермедиата, где положительный заряд делокализован и все атомы имеют октет, намного выше, чем стабильность исходного третичного карбокатиона. Поэтому активационный барьер для перегруппировки ниже, чем для реакции элиминирования, и этот процесс протекает быстрее. Кроме того, конечный продукт пинаколон является термодинамически очень стабильным соединением из-за наличия прочной двойной связи $C=O$.
Ответ: При взаимодействии пинакона с кислотой происходит структурная перегруппировка, а не дегидратация, потому что ключевая стадия механизма — 1,2-метильный сдвиг в образовавшемся третичном карбокатионе — приводит к образованию значительно более стабильного резонансно-стабилизированного интермедиата (протонированного кетона). Этот путь является кинетически и термодинамически более выгодным, чем альтернативный путь элиминирования, который привел бы к продуктам дегидратации. Движущей силой перегруппировки является стремление системы к образованию наиболее стабильного из возможных катионных интермедиатов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 66 расположенного на странице 93 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №66 (с. 93), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















