Номер 6, страница 76 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава IV. Арены (ароматические углеводороды). Параграф 16. Свойства бензола и его гомологов. Подумайте, ответьте, выполните... - номер 6, страница 76.
№6 (с. 76)
Условие. №6 (с. 76)
скриншот условия

6. К 39 г бензола в присутствии хлорида железа(III) добавили 1 моль брома. Какие вещества получились в результате реакции? Чему равны их массы?
Решение. №6 (с. 76)

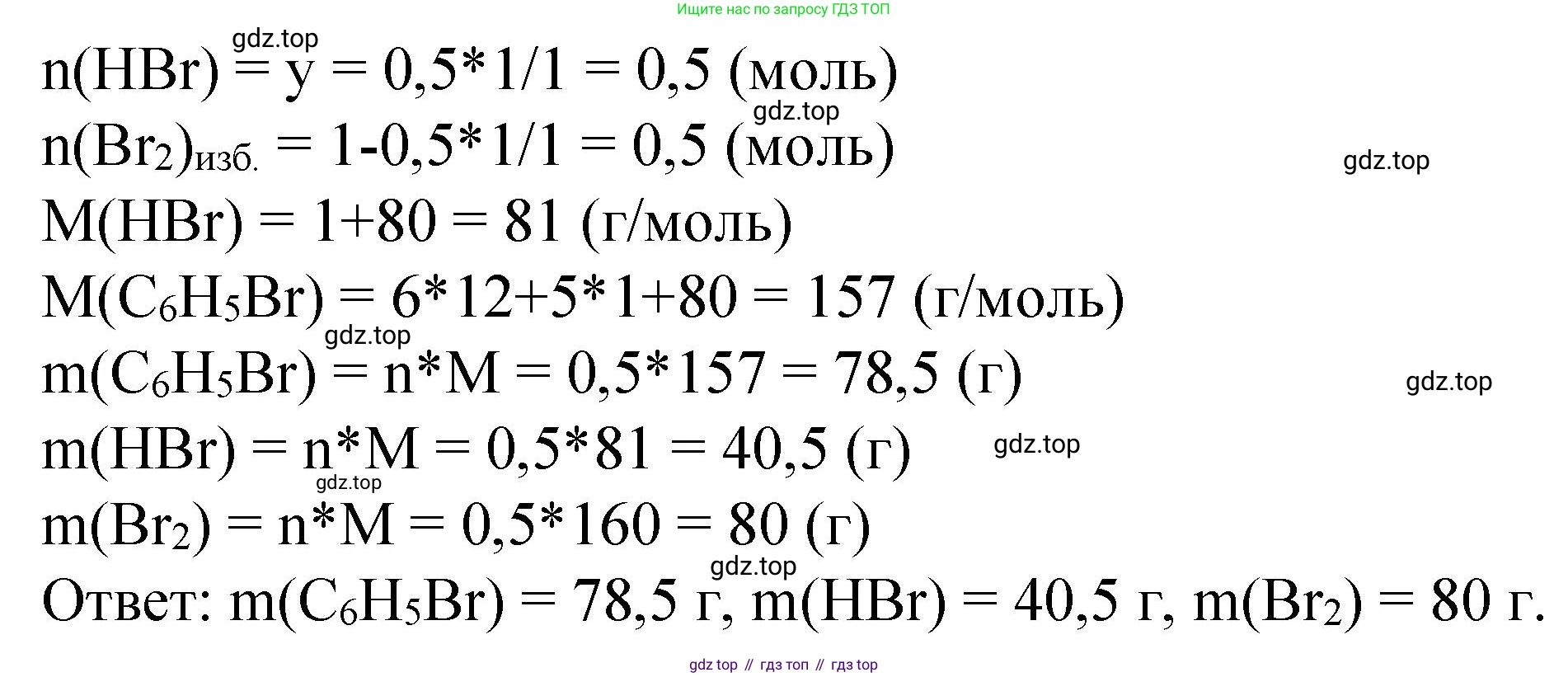
Решение 2. №6 (с. 76)
Дано:
$m(C_6H_6) = 39 \text{ г}$
$n(Br_2) = 1 \text{ моль}$
Катализатор: $FeCl_3$
Найти:
Вещества, получившиеся в результате реакции - ?
Массы этих веществ - ?
Решение:
1. Запишем уравнение реакции бромирования бензола. Реакция протекает в присутствии катализатора (кислоты Льюиса, в данном случае хлорида железа(III)) и представляет собой электрофильное замещение в ароматическом кольце:
$C_6H_6 + Br_2 \xrightarrow{FeCl_3} C_6H_5Br + HBr$
В результате реакции образуются бромбензол ($C_6H_5Br$) и бромоводород ($HBr$).
2. Рассчитаем количество вещества бензола ($C_6H_6$).
Молярная масса бензола:
$M(C_6H_6) = 6 \cdot Ar(C) + 6 \cdot Ar(H) = 6 \cdot 12 + 6 \cdot 1 = 78 \text{ г/моль}$
Количество вещества бензола:
$n(C_6H_6) = \frac{m(C_6H_6)}{M(C_6H_6)} = \frac{39 \text{ г}}{78 \text{ г/моль}} = 0.5 \text{ моль}$
3. Определим, какое из реагирующих веществ находится в недостатке (является лимитирующим реагентом).
По уравнению реакции, бензол и бром реагируют в мольном соотношении 1:1.
У нас есть $0.5 \text{ моль}$ бензола и $1 \text{ моль}$ брома.
Поскольку $n(C_6H_6) < n(Br_2)$ ($0.5 \text{ моль} < 1 \text{ моль}$), бензол является лимитирующим реагентом. Это означает, что он прореагирует полностью, а бром останется в избытке. Дальнейшие расчеты ведем по бензолу.
4. Рассчитаем количества веществ продуктов реакции.
Согласно уравнению реакции:
$n(C_6H_5Br) = n(C_6H_6) = 0.5 \text{ моль}$
$n(HBr) = n(C_6H_6) = 0.5 \text{ моль}$
5. Рассчитаем массы продуктов реакции.
Молярная масса бромбензола ($C_6H_5Br$):
$M(C_6H_5Br) = 6 \cdot 12 + 5 \cdot 1 + 1 \cdot 80 = 157 \text{ г/моль}$
Масса бромбензола:
$m(C_6H_5Br) = n(C_6H_5Br) \cdot M(C_6H_5Br) = 0.5 \text{ моль} \cdot 157 \text{ г/моль} = 78.5 \text{ г}$
Молярная масса бромоводорода ($HBr$):
$M(HBr) = 1 \cdot 1 + 1 \cdot 80 = 81 \text{ г/моль}$
Масса бромоводорода:
$m(HBr) = n(HBr) \cdot M(HBr) = 0.5 \text{ моль} \cdot 81 \text{ г/моль} = 40.5 \text{ г}$
6. Также определим массу непрореагировавшего брома, который останется в реакционной смеси.
Количество прореагировавшего брома: $n(Br_2)_{\text{прореаг.}} = n(C_6H_6) = 0.5 \text{ моль}$
Количество оставшегося брома: $n(Br_2)_{\text{ост.}} = n(Br_2)_{\text{исх.}} - n(Br_2)_{\text{прореаг.}} = 1 \text{ моль} - 0.5 \text{ моль} = 0.5 \text{ моль}$
Молярная масса брома ($Br_2$):
$M(Br_2) = 2 \cdot 80 = 160 \text{ г/моль}$
Масса оставшегося брома:
$m(Br_2)_{\text{ост.}} = n(Br_2)_{\text{ост.}} \cdot M(Br_2) = 0.5 \text{ моль} \cdot 160 \text{ г/моль} = 80 \text{ г}$
Ответ: В результате реакции получились бромбензол ($C_6H_5Br$) и бромоводород ($HBr$). Их массы равны: масса бромбензола - $78.5 \text{ г}$, масса бромоводорода - $40.5 \text{ г}$. В реакционной смеси также остался непрореагировавший бром ($Br_2$) массой $80 \text{ г}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 6 расположенного на странице 76 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 76), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.



















