Номер 7, страница 98 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава VI. Спирты и фенолы. Параграф 20. Получение, химические свойства и применение одноатомных предельных спиртов. Подумайте, ответьте, выполните... - номер 7, страница 98.
№7 (с. 98)
Условие. №7 (с. 98)
скриншот условия

7. $CO_2$, который образовался при сбраживании 100 г раствора $C_6H_{12}O_6$, пропустили через $Ca(OH)_2$. В осадок выпало 10 г $CaCO_3$. Вычислите массовую долю $C_6H_{12}O_6$ в растворе.
Решение. №7 (с. 98)

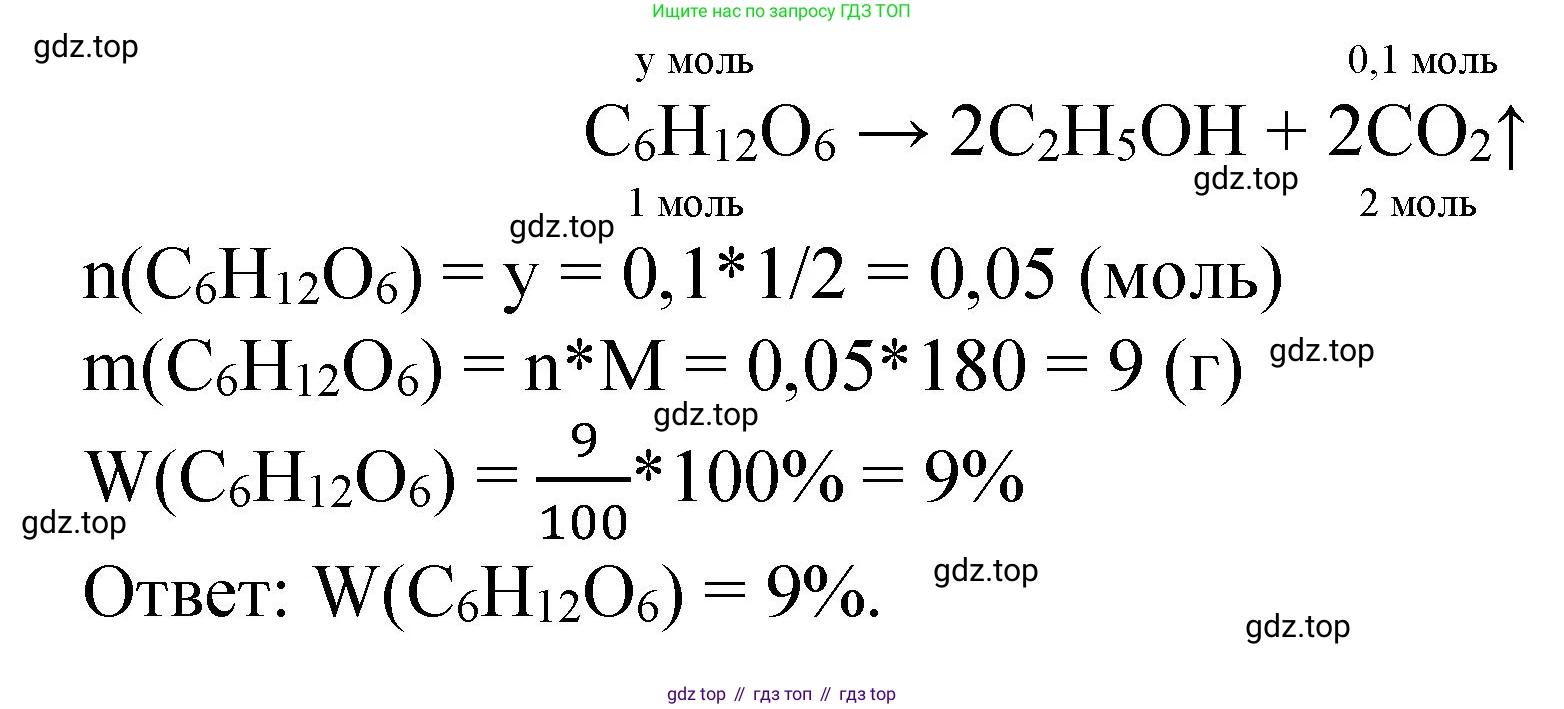
Решение 2. №7 (с. 98)
Дано:
$m_{раствора}(C_6H_{12}O_6) = 100 \text{ г}$
$m(CaCO_3) = 10 \text{ г}$
Найти:
$\omega(C_6H_{12}O_6) - ?$
Решение:
1. Запишем уравнения химических реакций, описанных в задаче.
Первая реакция — спиртовое брожение глюкозы, в результате которого образуется этанол и оксид углерода(IV):
$C_6H_{12}O_6 \rightarrow 2C_2H_5OH + 2CO_2\uparrow$ (1)
Вторая реакция — взаимодействие выделившегося оксида углерода(IV) с гидроксидом кальция (известковой водой) с образованием нерастворимого осадка карбоната кальция:
$CO_2 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + H_2O$ (2)
2. Расчет начнем с известного продукта — карбоната кальция. Вычислим его молярную массу и количество вещества.
Молярная масса карбоната кальция $M(CaCO_3)$:
$M(CaCO_3) = 40 + 12 + 3 \cdot 16 = 100 \text{ г/моль}$
Количество вещества карбоната кальция $n(CaCO_3)$:
$n(CaCO_3) = \frac{m(CaCO_3)}{M(CaCO_3)} = \frac{10 \text{ г}}{100 \text{ г/моль}} = 0.1 \text{ моль}$
3. По уравнению реакции (2) найдем количество вещества оксида углерода(IV), который прореагировал с гидроксидом кальция. Согласно стехиометрическим коэффициентам, соотношение $n(CO_2) : n(CaCO_3)$ равно 1:1.
$n(CO_2) = n(CaCO_3) = 0.1 \text{ моль}$
4. Весь этот оксид углерода(IV) образовался в результате брожения глюкозы. По уравнению реакции (1) найдем количество вещества глюкозы. Соотношение $n(C_6H_{12}O_6) : n(CO_2)$ равно 1:2.
$n(C_6H_{12}O_6) = \frac{1}{2} n(CO_2) = \frac{1}{2} \cdot 0.1 \text{ моль} = 0.05 \text{ моль}$
5. Теперь вычислим массу глюкозы, которая содержалась в исходном растворе. Для этого сначала определим молярную массу глюкозы $M(C_6H_{12}O_6)$:
$M(C_6H_{12}O_6) = 6 \cdot 12 + 12 \cdot 1 + 6 \cdot 16 = 72 + 12 + 96 = 180 \text{ г/моль}$
Масса глюкозы $m(C_6H_{12}O_6)$:
$m(C_6H_{12}O_6) = n(C_6H_{12}O_6) \cdot M(C_6H_{12}O_6) = 0.05 \text{ моль} \cdot 180 \text{ г/моль} = 9 \text{ г}$
6. На последнем этапе вычислим массовую долю глюкозы ($\omega$) в растворе по формуле:
$\omega(C_6H_{12}O_6) = \frac{m(C_6H_{12}O_6)}{m_{раствора}} \cdot 100\%$
$\omega(C_6H_{12}O_6) = \frac{9 \text{ г}}{100 \text{ г}} \cdot 100\% = 9\%$
Ответ: массовая доля глюкозы в растворе составляет 9%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 7 расположенного на странице 98 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 98), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.



















