Номер 2.17, страница 48, часть II - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: II
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть II. Вычисления по химическим уравнениям. 2. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей - номер 2.17, страница 48.
№2.17 (с. 48)
Условие. №2.17 (с. 48)
скриншот условия

2.17. На обжиг цинковой обманки массой 200 г был израсходован кислород объемом 33,6 л (н. у.). Вычислите массовую долю (в процентах) ZnS в цинковой обманке.
Решение. №2.17 (с. 48)

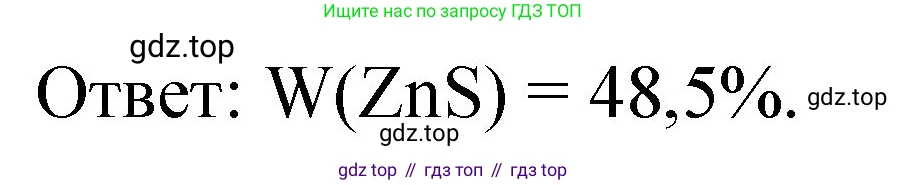
Решение 2. №2.17 (с. 48)
Дано
m(цинковой обманки) = 200 г
V(O₂) = 33,6 л (н. у.)
m(цинковой обманки) = 0,2 кг
V(O₂) = 0,0336 м³
Найти:
ω(ZnS) - ?
Решение
1. Цинковая обманка — это руда, основным компонентом которой является сульфид цинка (ZnS). При обжиге происходит реакция сульфида цинка с кислородом. Составим уравнение этой химической реакции:
$$2ZnS + 3O_2 \rightarrow 2ZnO + 2SO_2$$
Из уравнения видно, что в реакцию с кислородом вступает только чистый сульфид цинка, содержащийся в руде.
2. Рассчитаем количество вещества (число молей) кислорода, которое было израсходовано на обжиг. Поскольку объем кислорода дан при нормальных условиях (н. у.), мы можем использовать молярный объем газа, который при н. у. равен $V_m = 22,4$ л/моль.
$$n(O_2) = \frac{V(O_2)}{V_m} = \frac{33,6 \text{ л}}{22,4 \text{ л/моль}} = 1,5 \text{ моль}$$
3. Используя уравнение реакции, найдем количество вещества сульфида цинка (ZnS), которое прореагировало. Согласно стехиометрическим коэффициентам в уравнении, соотношение количеств вещества ZnS и O₂ равно 2 к 3.
$$\frac{n(ZnS)}{2} = \frac{n(O_2)}{3}$$
Отсюда выразим и вычислим количество вещества ZnS:
$$n(ZnS) = \frac{2}{3} \cdot n(O_2) = \frac{2}{3} \cdot 1,5 \text{ моль} = 1 \text{ моль}$$
4. Теперь вычислим массу чистого сульфида цинка, содержавшегося в руде. Для этого сначала найдем молярную массу ZnS, используя относительные атомные массы цинка (Zn) и серы (S) из периодической таблицы (Ar(Zn) ≈ 65, Ar(S) ≈ 32).
$$M(ZnS) = Ar(Zn) + Ar(S) = 65 \text{ г/моль} + 32 \text{ г/моль} = 97 \text{ г/моль}$$
Теперь можем рассчитать массу ZnS:
$$m(ZnS) = n(ZnS) \cdot M(ZnS) = 1 \text{ моль} \cdot 97 \text{ г/моль} = 97 \text{ г}$$
5. Зная массу чистого ZnS (97 г) и общую массу цинковой обманки (200 г), мы можем вычислить массовую долю ZnS в образце руды.
$$\omega(ZnS) = \frac{m(ZnS)}{m(\text{цинковой обманки})} \cdot 100\%$$
$$\omega(ZnS) = \frac{97 \text{ г}}{200 \text{ г}} \cdot 100\% = 0,485 \cdot 100\% = 48,5\%$$
Ответ: массовая доля ZnS в цинковой обманке составляет 48,5%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 2.17 расположенного на странице 48 для II-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2.17 (с. 48), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), II-й части учебного пособия издательства Просвещение.
















