Номер 2, страница 194 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 8. Первоначальные представления об органических веществах. Параграф 56. Карбоновые кислоты. Сложные эфиры. Жиры. Подумай, ответь, выполни... - номер 2, страница 194.
№2 (с. 194)
Условие. №2 (с. 194)
скриншот условия

2. Рассмотрите химические свойства карбоновых кислот на примере пропионовой кислоты $C_2H_5COOH$. Запишите уравнения соответствующих химических реакций.
Решение. №2 (с. 194)

Решение 2. №2 (с. 194)
Пропионовая (пропановая) кислота, $C_2H_5COOH$, как представитель класса предельных одноосновных карбоновых кислот, обладает рядом характерных химических свойств, которые обусловлены наличием в её молекуле функциональной карбоксильной группы $-COOH$ и углеводородного радикала.
1. Кислотные свойства
Карбоновые кислоты являются слабыми электролитами. В водных растворах пропионовая кислота обратимо диссоциирует на пропионат-ион и ион водорода, что и обуславливает её кислотные свойства:
$C_2H_5COOH \rightleftharpoons C_2H_5COO^- + H^+$
Как кислота, она вступает в реакции с металлами, основными оксидами, основаниями и солями более слабых кислот.
Взаимодействие с активными металлами (например, с натрием) с образованием соли (пропионата натрия) и выделением водорода:
$2C_2H_5COOH + 2Na \rightarrow 2C_2H_5COONa + H_2 \uparrow$
Взаимодействие с основными оксидами (например, с оксидом кальция) с образованием соли (пропионата кальция) и воды:
$2C_2H_5COOH + CaO \rightarrow (C_2H_5COO)_2Ca + H_2O$
Реакция нейтрализации с основаниями (например, с гидроксидом калия) с образованием соли (пропионата калия) и воды:
$C_2H_5COOH + KOH \rightarrow C_2H_5COOK + H_2O$
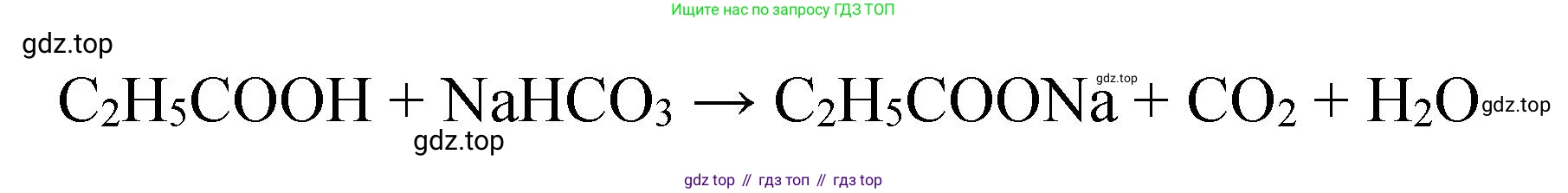
Взаимодействие с солями более слабых кислот (например, с карбонатом натрия). Пропионовая кислота, будучи более сильной, чем угольная, вытесняет её из раствора в виде углекислого газа:
$2C_2H_5COOH + Na_2CO_3 \rightarrow 2C_2H_5COONa + H_2O + CO_2 \uparrow$
Ответ: Уравнения реакций, демонстрирующих кислотные свойства пропионовой кислоты: $2C_2H_5COOH + 2Na \rightarrow 2C_2H_5COONa + H_2 \uparrow$; $2C_2H_5COOH + CaO \rightarrow (C_2H_5COO)_2Ca + H_2O$; $C_2H_5COOH + KOH \rightarrow C_2H_5COOK + H_2O$; $2C_2H_5COOH + Na_2CO_3 \rightarrow 2C_2H_5COONa + H_2O + CO_2 \uparrow$.
2. Реакция этерификации
Это реакция образования сложных эфиров при взаимодействии карбоновых кислот со спиртами. Реакция катализируется сильными кислотами (например, $H_2SO_4$) и является обратимой. При взаимодействии пропионовой кислоты с этанолом образуется этилпропионат (этиловый эфир пропионовой кислоты) и вода.
$C_2H_5COOH + C_2H_5OH \rightleftharpoons C_2H_5COOC_2H_5 + H_2O$
Ответ: Уравнение реакции этерификации пропионовой кислоты с этанолом: $C_2H_5COOH + C_2H_5OH \rightleftharpoons C_2H_5COOC_2H_5 + H_2O$.
3. Образование галогенангидридов
Гидроксильная группа $-OH$ в составе карбоксильной группы может быть замещена на атом галогена при действии галогенирующих агентов, таких как хлорид фосфора(V) ($PCl_5$), с образованием хлорангидрида пропионовой кислоты (пропионилхлорида).
$C_2H_5COOH + PCl_5 \rightarrow C_2H_5COCl + POCl_3 + HCl$
Ответ: Уравнение реакции получения пропионилхлорида: $C_2H_5COOH + PCl_5 \rightarrow C_2H_5COCl + POCl_3 + HCl$.
4. Реакции по углеводородному радикалу (галогенирование)
Для карбоновых кислот характерна реакция замещения атомов водорода в $\alpha$-положении (углеродный атом, соседний с карбоксильной группой) на атом галогена (реакция Гелля–Фольгарда–Зелинского). Реакция протекает в присутствии катализатора — красного фосфора. При взаимодействии пропионовой кислоты с бромом образуется 2-бромпропановая кислота.
$CH_3CH_2COOH + Br_2 \xrightarrow{P_{красный}} CH_3CH(Br)COOH + HBr$
Ответ: Уравнение реакции галогенирования пропионовой кислоты по $\alpha$-углеродному атому: $CH_3CH_2COOH + Br_2 \xrightarrow{P_{красный}} CH_3CH(Br)COOH + HBr$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 194 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 194), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















