Номер 26, страница 9 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.1. Структурная теория органических соединений. Уровень 2 - номер 26, страница 9.
№26 (с. 9)
Условие. №26 (с. 9)

1.26. Кроме углерода цепочечные структуры могут образовывать также фосфор, кремний и бор. Почему эти элементы не дают такого многообразия соединений, как углерод?
Решение. №26 (с. 9)
Решение 3. №26 (с. 9)
Способность атомов химического элемента образовывать устойчивые химические связи друг с другом, формируя цепи и циклы, называется катенацией. Углерод обладает этой способностью в наивысшей степени, что и обуславливает огромное многообразие органических соединений. Фосфор, кремний и бор также могут образовывать цепи, но в значительно меньшей степени. Это связано с несколькими ключевыми факторами.
- Прочность связи элемент-элемент.
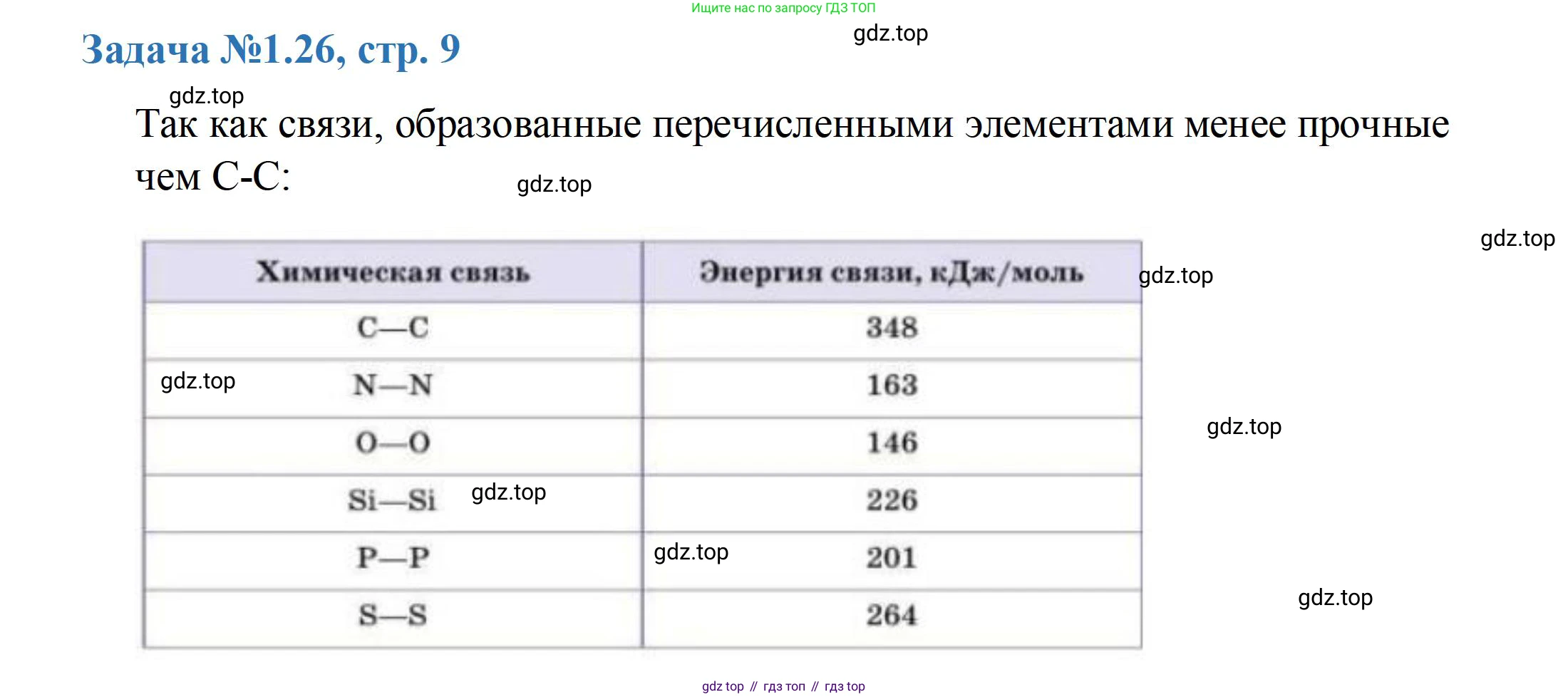
Одной из главных причин является исключительно высокая энергия одинарной связи углерод-углерод (C-C) по сравнению с другими элементами. Эта связь очень прочна и стабильна, что позволяет формировать длинные и устойчивые молекулярные цепи и кольца.
- Энергия связи $C-C$ составляет примерно $348 \text{ кДж/моль}$.
- Энергия связи $Si-Si$ значительно ниже — около $226 \text{ кДж/моль}$.
- Энергия связи $P-P$ еще ниже — около $200 \text{ кДж/моль}$.
- Энергия связи $B-B$ составляет около $293 \text{ кДж/моль}$, но химия бора осложнена его электронной недостаточностью.
Более слабые связи $Si-Si$ и $P-P$ означают, что длинные цепи из этих атомов термодинамически менее стабильны и легче распадаются.
- Соотношение прочности связей с другими элементами.
Не менее важным является то, что прочность связи $C-C$ сопоставима с прочностью связей, которые углерод образует с другими элементами, например, с кислородом ($C-O$, около $358 \text{ кДж/моль}$) и водородом ($C-H$, около $413 \text{ кДж/моль}$). Это означает, что углеродный скелет молекулы не является "слабым звеном" и устойчив к атаке таких реагентов, как вода или кислород.
В случае кремния ситуация иная. Связь $Si-O$ (около $452 \text{ кДж/моль}$) намного прочнее связи $Si-Si$ ($226 \text{ кДж/моль}$). Поэтому соединения с цепями $Si-Si$ (силаны) термодинамически нестабильны и легко окисляются до соединений с гораздо более прочными цепями $-Si-O-Si-$ (силоксаны). По этой причине химия кремния — это в основном химия соединений с кремний-кислородными связями, а не кремний-кремниевыми.
- Способность к образованию кратных (двойных и тройных) связей.
Углерод, как элемент 2-го периода, имеет небольшой атомный радиус, что обеспечивает эффективное перекрывание p-орбиталей и образование стабильных $\pi$-связей. Это позволяет углероду легко формировать прочные двойные ($C=C$) и тройные ($C \equiv C$) связи. Наличие кратных связей экспоненциально увеличивает число возможных структур (алкены, алкины, арены и т.д.).
Элементы 3-го периода, такие как кремний и фосфор, имеют значительно большие атомные радиусы. Из-за этого боковое перекрывание их p-орбиталей неэффективно, и образуемые ими $\pi$-связи очень слабые и реакционноспособные. Поэтому соединения с двойными связями $Si=Si$ или $P=P$ встречаются редко, неустойчивы и не вносят такого вклада в многообразие соединений, как у углерода.
- Особенности строения атомов.
Углерод (C): Имеет 4 валентных электрона и валентность IV. Это позволяет ему образовывать четыре прочные ковалентные связи, создавая разветвленные и сложные трехмерные структуры.
Кремний (Si): Аналог углерода, но его химия ограничена причинами, указанными выше (слабая связь $Si-Si$, неспособность образовывать стабильные кратные связи).
Бор (B): Имеет только 3 валентных электрона. Его соединения являются электронно-дефицитными. Вместо классических двухэлектронных связей бор образует сложные многоцентровые связи, что приводит к совершенно другой химии кластеров (боранов), нежели к химии длинных цепей.
Фосфор (P): Обычно проявляет валентность III или V. Хотя он и образует цепи (например, в фосфанах), они, как уже отмечалось, значительно менее стабильны, чем углеводородные.
Ответ: Элементы, такие как фосфор, кремний и бор, не образуют такого многообразия соединений, как углерод, из-за совокупности нескольких факторов. Во-первых, энергия связи "элемент-элемент" для них значительно ниже, чем для связи $C-C$, что делает их цепи менее стабильными. Во-вторых, их связи с другими элементами (особенно с кислородом) часто оказываются намного прочнее, чем связи "элемент-элемент", что приводит к лёгкому разрушению цепей. В-третьих, в отличие от углерода, они не способны образовывать стабильные кратные (двойные и тройные) связи, что резко ограничивает структурное разнообразие. Наконец, специфические электронные конфигурации (например, электронный дефицит у бора) также ограничивают их способность к образованию длинных и разнообразных цепей, аналогичных углеродным.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 26 расположенного на странице 9 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №26 (с. 9), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















