Номер 159, страница 47 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 2. Углеводороды. 2.2. Углеводороды с двойной связью. Уровень 2 - номер 159, страница 47.
№159 (с. 47)
Условие. №159 (с. 47)

2.159. Изобразите схему взаимодействия р-орбиталей в молекуле бутадиена-1,3. Возможно ли вращение молекулы бутадиена-1,3 вокруг связи С(2)–С(3)? Как соотносится энергетический барьер данного процесса с энергетическим барьером вращения вокруг связи С–С в молекулах этана и этилена?
Решение. №159 (с. 47)
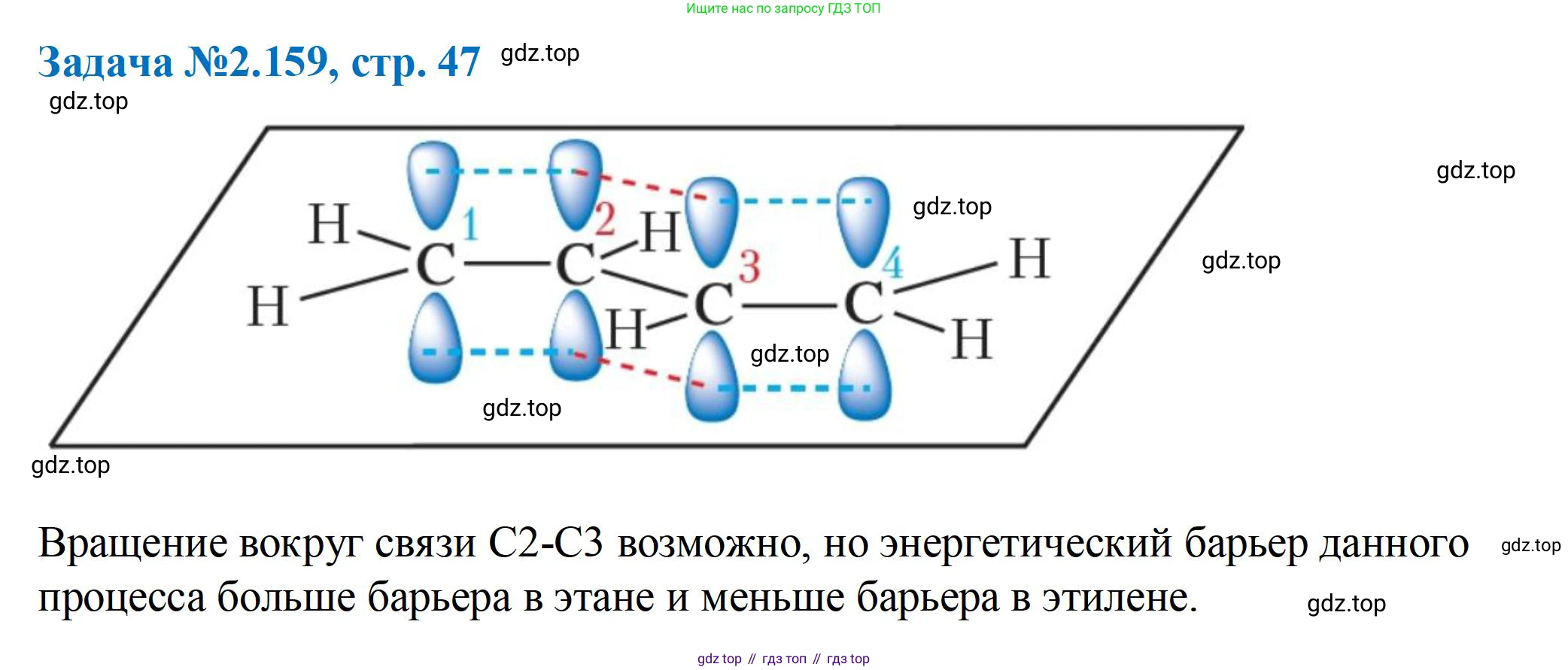
Решение 3. №159 (с. 47)
Изобразите схему взаимодействия p-орбиталей в молекуле бутадиена-1,3.
Молекула бутадиена-1,3 имеет строение $CH_2=CH-CH=CH_2$. Все четыре атома углерода в этой молекуле находятся в состоянии $sp^2$-гибридизации. Это означает, что каждый атом углерода образует три $\sigma$-связи, лежащие в одной плоскости под углом примерно $120^\circ$ друг к другу. У каждого из четырех атомов углерода остается по одной негибридизованной p-орбитали, которая расположена перпендикулярно плоскости молекулы.
Эти четыре p-орбитали параллельны друг другу и перекрываются, образуя единую сопряженную $\pi$-электронную систему. Боковое перекрывание происходит не только между p-орбиталями атомов C(1) и C(2) и атомов C(3) и C(4) (образуя две локализованные $\pi$-связи), но и между p-орбиталями центральных атомов C(2) и C(3).
Схематически это можно представить так: скелет из четырех атомов углерода лежит в одной плоскости, а над и под этой плоскостью располагаются четыре p-орбитали, каждая из которых имеет две доли (положительную и отрицательную). Все четыре "верхние" доли перекрываются друг с другом, и все четыре "нижние" доли также перекрываются. В результате четыре $\pi$-электрона не принадлежат конкретным парам атомов, а делокализованы (размазаны) по всей системе из четырех атомов углерода.
Схематическое изображение:
Ответ: В молекуле бутадиена-1,3 четыре параллельные p-орбитали ($sp^2$-гибридизованных атомов углерода) перекрываются между собой, образуя единую сопряженную $\pi$-электронную систему, делокализованную по всем четырем атомам углерода.
Возможно ли вращение молекулы бутадиена-1,3 вокруг связи С(2)—С(3)?
Формально связь C(2)—C(3) в бутадиене-1,3 является одинарной $\sigma$-связью. Вращение вокруг одинарных связей обычно является свободным (как, например, в этане). Однако в случае бутадиена-1,3 ситуация иная из-за наличия сопряженной $\pi$-системы.
Для максимальной эффективности сопряжения и делокализации электронов необходимо, чтобы все четыре p-орбитали были параллельны друг другу. Это достигается при плоском строении молекулы. Если начнется вращение вокруг центральной связи C(2)—C(3), то p-орбитали на атомах C(2) и C(3) начнут выходить из параллельного расположения. Это приведет к нарушению их перекрывания, а значит, к разрушению единой сопряженной системы. При повороте на $90^\circ$ перекрывание между p-орбиталями C(2) и C(3) полностью исчезает.
Разрушение сопряжения энергетически невыгодно, так как сопряженная система более стабильна. Поэтому для вращения вокруг связи C(2)—C(3) необходимо преодолеть энергетический барьер, равный по величине энергии стабилизации за счет сопряжения. Этот барьер делает вращение затрудненным, но не невозможным. При сообщении достаточной энергии (например, при нагревании) такое вращение может происходить.
Ответ: Да, вращение возможно, но оно значительно затруднено по сравнению со вращением вокруг простой одинарной связи из-за необходимости разрыва сопряжения $\pi$-электронной системы, что требует затрат энергии.
Как соотносится энергетический барьер данного процесса с энергетическим барьером вращения вокруг связи С—С в молекулах этана и этилена?
Энергетические барьеры вращения для этих трех молекул существенно различаются:
- Этан ($CH_3—CH_3$): Вращение вокруг одинарной C—C связи практически свободное. Энергетический барьер очень низок (около 12 кДж/моль) и обусловлен в основном торсионным напряжением — отталкиванием атомов водорода при их сближении в заслоненной конформации. Сама $\sigma$-связь имеет цилиндрическую симметрию и не препятствует вращению.
- Бутадиен-1,3 ($CH_2=CH—CH=CH_2$): Вращение вокруг центральной связи C(2)—C(3) требует разрыва сопряжения. Эта связь имеет частичный характер двойной связи. Энергетический барьер составляет примерно 20-30 кДж/моль. Он значительно выше, чем в этане, но намного ниже, чем барьер вращения вокруг двойной связи.
- Этилен ($CH_2=CH_2$): Вращение вокруг двойной C=C связи фактически невозможно в обычных условиях. Двойная связь состоит из одной $\sigma$- и одной $\pi$-связи. Для вращения необходимо полностью разорвать $\pi$-связь, что требует очень больших затрат энергии (около 264 кДж/моль). Поэтому барьер вращения чрезвычайно высок.
Таким образом, энергетические барьеры вращения соотносятся следующим образом:
Барьер(этан) < Барьер(бутадиен-1,3) < Барьер(этилен)
Ответ: Энергетический барьер вращения вокруг связи C(2)—C(3) в бутадиене-1,3 значительно выше, чем барьер вращения вокруг одинарной связи C—C в этане (из-за необходимости разрушить сопряжение), но гораздо ниже, чем барьер вращения вокруг двойной связи C=C в этилене (поскольку разрывается не полноценная $\pi$-связь, а лишь слабое $\pi$-взаимодействие между центральными атомами).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 159 расположенного на странице 47 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №159 (с. 47), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















