Номер 101, страница 308 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 11. Теоретическое описание химических реакций. 11.2. Энтропия и энергия Гиббса. Химическое равновесие. 11.2.2. Химическое равновесие в газовой фазе. Уровень 2 - номер 101, страница 308.
№101 (с. 308)
Условие. №101 (с. 308)

11.101. Вещество А может находиться в двух близких по энергии формах, А(I) и А(II). Каждая из форм способна разлагаться с образованием одних и тех же продуктов, В и С:
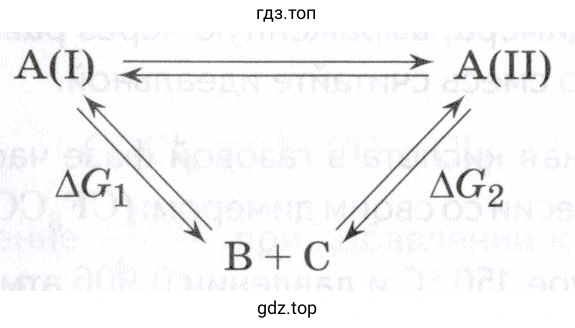
Известно, что = 18,7 кДж/моль, = 17,3 кДж/моль. (Энергии Гиббса приведены для реакций разложения.)
1) Рассчитайте равновесные мольные доли форм А(I) и А(II) в веществе А при 25 °C.
2) Рассчитайте кажущуюся константу равновесия разложения А (из обеих форм) на В и С при 25 °C.
Решение 3. №101 (с. 308)
Дано:
Стандартная энергия Гиббса реакции разложения формы A(I): $\Delta G_1^\circ = 18,7$ кДж/моль
Стандартная энергия Гиббса реакции разложения формы A(II): $\Delta G_2^\circ = 17,3$ кДж/моль
Температура: $T = 25$ °C
Универсальная газовая постоянная: $R = 8,314$ Дж/(моль·К)
Перевод в систему СИ:
$\Delta G_1^\circ = 18700$ Дж/моль
$\Delta G_2^\circ = 17300$ Дж/моль
$T = 25 + 273,15 = 298,15$ K
Найти:
1) Равновесные мольные доли форм A(I) и A(II), $x_{A(I)}$ и $x_{A(II)}$.
2) Кажущуюся константу равновесия разложения A, $K_{каж}$.
Решение:
1) Рассчитайте равновесные мольные доли форм A(I) и A(II) в веществе A при 25 °С.
Формы A(I) и A(II) находятся в равновесии друг с другом согласно реакции изомеризации: $$ A(I) \rightleftharpoons A(II) $$ Константа этого равновесия, $K_{iso}$, связана со стандартным изменением энергии Гиббса этой реакции, $\Delta G_{iso}^\circ$. Мы можем найти $\Delta G_{iso}^\circ$ из термодинамического цикла, используя данные по реакциям разложения:
(1) $A(I) \rightleftharpoons B + C \quad (\Delta G_1^\circ)$
(2) $A(II) \rightleftharpoons B + C \quad (\Delta G_2^\circ)$
Чтобы получить реакцию изомеризации $A(I) \rightleftharpoons A(II)$, необходимо из реакции (1) вычесть реакцию (2). Соответственно, изменение энергии Гиббса для реакции изомеризации будет равно разности энергий Гиббса реакций разложения: $$ \Delta G_{iso}^\circ = \Delta G_1^\circ - \Delta G_2^\circ = 18700 \text{ Дж/моль} - 17300 \text{ Дж/моль} = 1400 \text{ Дж/моль} $$ Теперь найдем константу равновесия $K_{iso}$ по формуле $\Delta G^\circ = -RT \ln K$: $$ K_{iso} = e^{-\frac{\Delta G_{iso}^\circ}{RT}} = e^{-\frac{1400}{8,314 \cdot 298,15}} \approx e^{-0,5648} \approx 0,5685 $$ Константа равновесия $K_{iso}$ представляет собой отношение равновесных мольных долей продуктов к реагентам: $$ K_{iso} = \frac{x_{A(II)}}{x_{A(I)}} $$ При этом сумма мольных долей равна единице: $$ x_{A(I)} + x_{A(II)} = 1 $$ Решим систему уравнений. Из второго уравнения $x_{A(II)} = 1 - x_{A(I)}$. Подставим в первое: $$ K_{iso} = \frac{1 - x_{A(I)}}{x_{A(I)}} \implies K_{iso} \cdot x_{A(I)} = 1 - x_{A(I)} \implies x_{A(I)}(K_{iso} + 1) = 1 $$ $$ x_{A(I)} = \frac{1}{1 + K_{iso}} = \frac{1}{1 + 0,5685} = \frac{1}{1,5685} \approx 0,6376 $$ Тогда мольная доля формы A(II) равна: $$ x_{A(II)} = 1 - x_{A(I)} = 1 - 0,6376 = 0,3624 $$
Ответ: Равновесная мольная доля формы A(I) составляет примерно 0,638 (или 63,8%), а формы A(II) - примерно 0,362 (или 36,2%).
2) Рассчитайте кажущуюся константу равновесия разложения A (из обеих форм) на B и C при 25 °С.
Кажущаяся (или наблюдаемая) константа равновесия, $K_{каж}$, для общего процесса разложения $A \rightleftharpoons B + C$ определяется как: $$ K_{каж} = \frac{[B][C]}{[A]_{общ}} $$ где $[A]_{общ} = [A(I)] + [A(II)]$ — общая концентрация вещества А. В системе одновременно устанавливаются равновесия для разложения каждой из форм, характеризуемые константами $K_1$ и $K_2$: $$ K_1 = \frac{[B][C]}{[A(I)]} \quad \text{и} \quad K_2 = \frac{[B][C]}{[A(II)]} $$ Выразим концентрацию $[A(I)]$ через мольную долю $x_{A(I)}$ и общую концентрацию $[A]_{общ}$: $[A(I)] = x_{A(I)} \cdot [A]_{общ}$. Подставим это выражение в формулу для $K_1$: $$ K_1 = \frac{[B][C]}{x_{A(I)}[A]_{общ}} $$ Заметив, что отношение $\frac{[B][C]}{[A]_{общ}}$ является искомой константой $K_{каж}$, получаем связь: $$ K_1 = \frac{K_{каж}}{x_{A(I)}} \implies K_{каж} = K_1 \cdot x_{A(I)} $$ Таким образом, для нахождения $K_{каж}$ нам нужно рассчитать $K_1$ и умножить ее на найденную в первом пункте мольную долю $x_{A(I)}$. Рассчитаем $K_1$: $$ K_1 = e^{-\frac{\Delta G_1^\circ}{RT}} = e^{-\frac{18700}{8,314 \cdot 298,15}} \approx e^{-7,5436} \approx 0,0005308 $$ Теперь вычислим кажущуюся константу равновесия: $$ K_{каж} = K_1 \cdot x_{A(I)} = 0,0005308 \cdot 0,6376 \approx 0,0003384 $$ Для проверки можно провести аналогичный расчет через $K_2$ и $x_{A(II)}$: $$ K_2 = e^{-\frac{\Delta G_2^\circ}{RT}} = e^{-\frac{17300}{8,314 \cdot 298,15}} \approx e^{-6,9788} \approx 0,0009314 $$ $$ K_{каж} = K_2 \cdot x_{A(II)} = 0,0009314 \cdot 0,3624 \approx 0,0003375 $$ Результаты практически совпадают, небольшое расхождение объясняется округлением промежуточных вычислений.
Ответ: Кажущаяся константа равновесия разложения A на B и C при 25 °С равна $3,38 \cdot 10^{-4}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 101 расположенного на странице 308 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №101 (с. 308), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















