Номер 245, страница 328 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 11. Теоретическое описание химических реакций. 11.3. Электрохимия. Электролиз и химические источники тока. Уровень 2 - номер 245, страница 328.
№245 (с. 328)
Условие. №245 (с. 328)
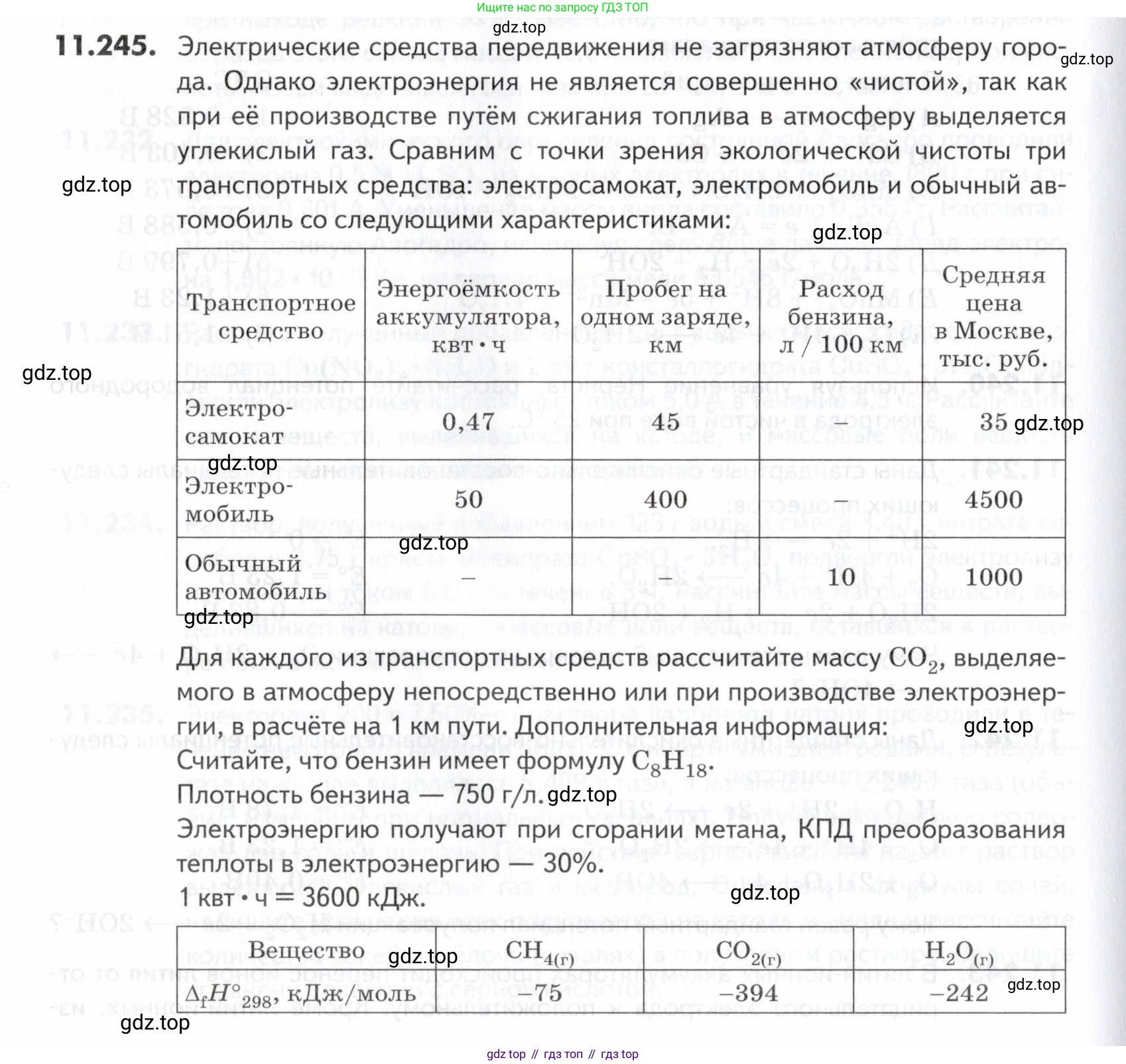
11.245. Электрические средства передвижения не загрязняют атмосферу города. Однако электроэнергия не является совершенно «чистой», так как при её производстве путём сжигания топлива в атмосферу выделяется углекислый газ. Сравним с точки зрения экологической чистоты три транспортных средства: электросамокат, электромобиль и обычный автомобиль со следующими характеристиками:
| Транспортное средство | Энергоёмкость аккумулятора, | Пробег на одном заряде, км | Расход бензина, л/100 км | Средняя цена в Москве, тыс. руб. |
| Электросамокат | 0,47 | 45 | - | 35 |
| Электромобиль | 50 | 400 | - | 4500 |
| Обычный автомобиль | - | - | 10 | 1000 |
Для каждого из транспортных средств рассчитайте массу выделяемого в атмосферу непосредственно или при производстве электроэнергии, в расчёте на 1 км пути. Дополнительная информация:
Считайте, что бензин имеет формулу
Плотность бензина – 750 г/л.
Электроэнергию получают при сгорании метана, КПД преобразования теплоты в электроэнергию – 30%.
= 3600 кДж.
| Вещество | |||
| кДж/моль | -75 | -394 | -242 |
Решение 3. №245 (с. 328)
Для решения задачи рассчитаем массу выбросов $CO_2$ на 1 км пути для каждого из трех транспортных средств: обычного автомобиля, электромобиля и электросамоката.
Дано:
Общие данные:
- Формула бензина (октан): $C_8H_{18}$
- Плотность бензина: $\rho_{бенз} = 750 \text{ г/л} = 750 \text{ кг/м}^3$
- Электроэнергия производится сжиганием метана ($CH_4$).
- КПД преобразования теплоты в электроэнергию: $\eta = 30\% = 0,3$
- Соотношение энергии: $1 \text{ кВт}\cdot\text{ч} = 3600 \text{ кДж}$
- Стандартные энтальпии образования, $\Delta_f H^\circ_{298}$ (кДж/моль):
- $CH_{4(г)}: -75$
- $CO_{2(г)}: -394$
- $H_2O_{(г)}: -242$
Характеристики транспортных средств:
- Электросамокат: энергоёмкость $W_{сам} = 0,47 \text{ кВт}\cdot\text{ч}$, пробег $L_{сам} = 45 \text{ км}$
- Электромобиль: энергоёмкость $W_{элм} = 50 \text{ кВт}\cdot\text{ч}$, пробег $L_{элм} = 400 \text{ км}$
- Обычный автомобиль: расход бензина $V_{расх} = 10 \text{ л / 100 км}$
Найти:
Массу $CO_2$, выделяемую в атмосферу в расчёте на 1 км пути для каждого транспортного средства ($m_{CO_2/км}$).
Решение:
1. Обычный автомобиль
Выбросы $CO_2$ происходят непосредственно при сжигании бензина в двигателе.
1. Рассчитаем расход бензина на 1 км пути:
$V_{1км} = \frac{10 \text{ л}}{100 \text{ км}} = 0,1 \text{ л/км}$
2. Найдем массу бензина, расходуемую на 1 км, используя его плотность:
$m_{бенз} = V_{1км} \cdot \rho_{бенз} = 0,1 \text{ л/км} \cdot 750 \text{ г/л} = 75 \text{ г/км}$
3. Запишем уравнение реакции полного сгорания октана ($C_8H_{18}$):
$2C_8H_{18} + 25O_2 \rightarrow 16CO_2 + 18H_2O$
Из уравнения следует, что из 2 моль октана образуется 16 моль углекислого газа, то есть из 1 моль октана образуется 8 моль $CO_2$.
4. Рассчитаем молярные массы октана и углекислого газа:
$M(C_8H_{18}) = 8 \cdot 12,01 + 18 \cdot 1,01 \approx 114,26 \text{ г/моль}$
$M(CO_2) = 12,01 + 2 \cdot 16,00 = 44,01 \text{ г/моль}$
5. Найдем количество вещества (моль) октана, сгорающего на 1 км:
$\nu(C_8H_{18}) = \frac{m_{бенз}}{M(C_8H_{18})} = \frac{75 \text{ г}}{114,26 \text{ г/моль}} \approx 0,6564 \text{ моль}$
6. По уравнению реакции найдем количество вещества $CO_2$:
$\nu(CO_2) = 8 \cdot \nu(C_8H_{18}) = 8 \cdot 0,6564 \text{ моль} \approx 5,251 \text{ моль}$
7. Рассчитаем массу $CO_2$, выделяемую на 1 км пути:
$m(CO_2) = \nu(CO_2) \cdot M(CO_2) = 5,251 \text{ моль} \cdot 44,01 \text{ г/моль} \approx 231,1 \text{ г}$
Ответ: Выбросы $CO_2$ для обычного автомобиля составляют примерно 231,1 г/км.
2. Электромобиль и электросамокат
Для электрических транспортных средств выбросы $CO_2$ происходят на этапе производства электроэнергии. Сначала рассчитаем общие параметры производства электроэнергии.
1. Запишем уравнение реакции горения метана ($CH_4$):
$CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O$
2. Рассчитаем тепловой эффект реакции (энтальпию сгорания) метана, используя данные стандартных энтальпий образования:
$\Delta_r H^\circ = \sum \nu \cdot \Delta_f H^\circ_{прод} - \sum \nu \cdot \Delta_f H^\circ_{исх}$
$\Delta_r H^\circ = [\Delta_f H^\circ(CO_2) + 2 \cdot \Delta_f H^\circ(H_2O)] - [\Delta_f H^\circ(CH_4) + 2 \cdot \Delta_f H^\circ(O_2)]$
$\Delta_r H^\circ = [-394 + 2 \cdot (-242)] - [-75 + 2 \cdot 0] = (-394 - 484) - (-75) = -878 + 75 = -803 \text{ кДж/моль}$
Знак "минус" означает, что теплота выделяется. При сгорании 1 моль $CH_4$ выделяется 803 кДж теплоты и образуется 1 моль $CO_2$ (массой 44,01 г).
2.1. Электросамокат
1. Рассчитаем потребление электроэнергии на 1 км пути:
$W_{1км} = \frac{W_{сам}}{L_{сам}} = \frac{0,47 \text{ кВт}\cdot\text{ч}}{45 \text{ км}} \approx 0,01044 \text{ кВт}\cdot\text{ч/км}$
2. Переведем это значение в кДж:
$E_{электр} = 0,01044 \text{ кВт}\cdot\text{ч/км} \cdot 3600 \frac{\text{кДж}}{\text{кВт}\cdot\text{ч}} \approx 37,6 \text{ кДж/км}$
3. Учтем КПД электростанции. Чтобы получить 37,6 кДж полезной электроэнергии, нужно произвести больше тепловой энергии:
$E_{тепл} = \frac{E_{электр}}{\eta} = \frac{37,6 \text{ кДж/км}}{0,3} \approx 125,3 \text{ кДж/км}$
4. Рассчитаем, сколько моль метана нужно сжечь, чтобы получить 125,3 кДж теплоты:
$\nu(CH_4) = \frac{E_{тепл}}{|\Delta_r H^\circ|} = \frac{125,3 \text{ кДж/км}}{803 \text{ кДж/моль}} \approx 0,156 \text{ моль/км}$
5. Согласно уравнению реакции горения, $\nu(CO_2) = \nu(CH_4)$. Рассчитаем массу $CO_2$:
$m(CO_2) = \nu(CO_2) \cdot M(CO_2) = 0,156 \text{ моль/км} \cdot 44,01 \text{ г/моль} \approx 6,9 \text{ г/км}$
Ответ: Выбросы $CO_2$ для электросамоката составляют примерно 6,9 г/км.
2.2. Электромобиль
1. Рассчитаем потребление электроэнергии на 1 км пути:
$W_{1км} = \frac{W_{элм}}{L_{элм}} = \frac{50 \text{ кВт}\cdot\text{ч}}{400 \text{ км}} = 0,125 \text{ кВт}\cdot\text{ч/км}$
2. Переведем это значение в кДж:
$E_{электр} = 0,125 \text{ кВт}\cdot\text{ч/км} \cdot 3600 \frac{\text{кДж}}{\text{кВт}\cdot\text{ч}} = 450 \text{ кДж/км}$
3. Учтем КПД электростанции для нахождения необходимой тепловой энергии:
$E_{тепл} = \frac{E_{электр}}{\eta} = \frac{450 \text{ кДж/км}}{0,3} = 1500 \text{ кДж/км}$
4. Рассчитаем, сколько моль метана нужно сжечь:
$\nu(CH_4) = \frac{E_{тепл}}{|\Delta_r H^\circ|} = \frac{1500 \text{ кДж/км}}{803 \text{ кДж/моль}} \approx 1,868 \text{ моль/км}$
5. Найдем массу $CO_2$, зная что $\nu(CO_2) = \nu(CH_4)$:
$m(CO_2) = \nu(CO_2) \cdot M(CO_2) = 1,868 \text{ моль/км} \cdot 44,01 \text{ г/моль} \approx 82,2 \text{ г/км}$
Ответ: Выбросы $CO_2$ для электромобиля составляют примерно 82,2 г/км.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 245 расположенного на странице 328 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №245 (с. 328), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















