Номер 250, страница 332 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 11. Теоретическое описание химических реакций. 11.4. Скорость химических реакций. Катализ. Уровень 1 - номер 250, страница 332.
№250 (с. 332)
Условие. №250 (с. 332)
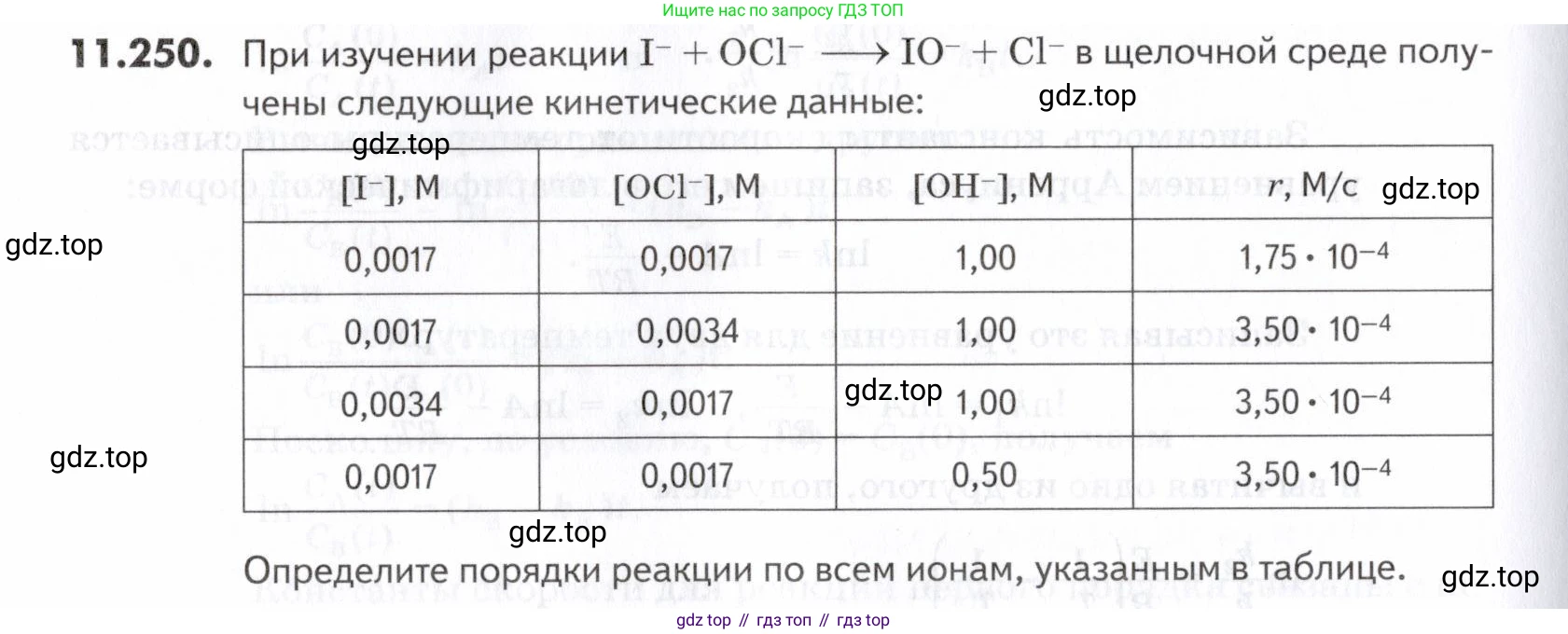
11.250. При изучении реакции в щелочной среде получены следующие кинетические данные:
| r, M/c | |||
| 0,0017 | 0,0017 | 1,00 | 1,75 |
| 0,0017 | 0,0034 | 1,00 | 3,50 |
| 0,0034 | 0,0017 | 1,00 | 3,50 |
| 0,0017 | 0,0017 | 0,5 | 3,50 |
Определите порядки реакции по всем ионам, указанным в таблице.
Решение 3. №250 (с. 332)
Дано:
Экспериментальные кинетические данные для реакции $I⁻ + OCl⁻ \rightarrow IO⁻ + Cl⁻$ в щелочной среде:
| [I⁻], М | [OCl⁻], М | [OH⁻], М | r, М/с |
|---|---|---|---|
| 0,0017 | 0,0017 | 1,00 | $1,75 \cdot 10^{-4}$ |
| 0,0017 | 0,0034 | 1,00 | $3,50 \cdot 10^{-4}$ |
| 0,0034 | 0,0017 | 1,00 | $3,50 \cdot 10^{-4}$ |
| 0,0017 | 0,0017 | 0,50 | $3,50 \cdot 10^{-4}$ |
Все данные представлены в единицах системы СИ (концентрация в моль/л, что эквивалентно М, время в секундах), поэтому перевод не требуется.
Найти:
Порядки реакции по всем ионам, указанным в таблице, т.е. по $I⁻$, $OCl⁻$ и $OH⁻$.
Решение:
Общий вид кинетического уравнения для данной реакции можно записать как: $r = k[I⁻]^x[OCl⁻]^y[OH⁻]^z$ где $r$ – скорость реакции, $k$ – константа скорости, $[I⁻]$, $[OCl⁻]$, $[OH⁻]$ – молярные концентрации ионов, а $x, y, z$ – частные порядки реакции по соответствующим ионам, которые нам необходимо определить.
Для нахождения порядков реакции воспользуемся методом начальных скоростей, сравнивая данные из разных экспериментов, в которых изменяется концентрация только одного вещества.
1. Определение порядка реакции по $OCl⁻$ (показатель $y$).
Сравним данные экспериментов 1 и 2. В этих опытах концентрации $[I⁻]$ и $[OH⁻]$ постоянны, а концентрация $[OCl⁻]$ увеличивается в 2 раза (с 0,0017 М до 0,0034 М). При этом скорость реакции также увеличивается в 2 раза (с $1,75 \cdot 10^{-4}$ до $3,50 \cdot 10^{-4}$ М/с).
Запишем отношение скоростей для этих двух экспериментов:
$\frac{r_2}{r_1} = \frac{k[I⁻]_2^x[OCl⁻]_2^y[OH⁻]_2^z}{k[I⁻]_1^x[OCl⁻]_1^y[OH⁻]_1^z} = \frac{k(0,0017)^x(0,0034)^y(1,00)^z}{k(0,0017)^x(0,0017)^y(1,00)^z} = (\frac{0,0034}{0,0017})^y = 2^y$
Подставим численные значения скоростей:
$\frac{3,50 \cdot 10^{-4}}{1,75 \cdot 10^{-4}} = 2$
Следовательно, $2 = 2^y$, откуда $y = 1$.
Таким образом, порядок реакции по иону $OCl⁻$ равен 1.
2. Определение порядка реакции по $I⁻$ (показатель $x$).
Сравним данные экспериментов 1 и 3. В этих опытах концентрации $[OCl⁻]$ и $[OH⁻]$ постоянны, а концентрация $[I⁻]$ увеличивается в 2 раза (с 0,0017 М до 0,0034 М). Скорость реакции при этом также увеличивается в 2 раза (с $1,75 \cdot 10^{-4}$ до $3,50 \cdot 10^{-4}$ М/с).
Запишем отношение скоростей:
$\frac{r_3}{r_1} = \frac{k[I⁻]_3^x[OCl⁻]_3^y[OH⁻]_3^z}{k[I⁻]_1^x[OCl⁻]_1^y[OH⁻]_1^z} = \frac{k(0,0034)^x(0,0017)^y(1,00)^z}{k(0,0017)^x(0,0017)^y(1,00)^z} = (\frac{0,0034}{0,0017})^x = 2^x$
Подставим значения скоростей:
$\frac{3,50 \cdot 10^{-4}}{1,75 \cdot 10^{-4}} = 2$
Следовательно, $2 = 2^x$, откуда $x = 1$.
Таким образом, порядок реакции по иону $I⁻$ равен 1.
3. Определение порядка реакции по $OH⁻$ (показатель $z$).
Сравним данные экспериментов 1 и 4. В этих опытах концентрации $[I⁻]$ и $[OCl⁻]$ постоянны, а концентрация $[OH⁻]$ уменьшается в 2 раза (с 1,00 М до 0,50 М). При этом скорость реакции увеличивается в 2 раза (с $1,75 \cdot 10^{-4}$ до $3,50 \cdot 10^{-4}$ М/с).
Запишем отношение скоростей:
$\frac{r_4}{r_1} = \frac{k[I⁻]_4^x[OCl⁻]_4^y[OH⁻]_4^z}{k[I⁻]_1^x[OCl⁻]_1^y[OH⁻]_1^z} = \frac{k(0,0017)^x(0,0017)^y(0,50)^z}{k(0,0017)^x(0,0017)^y(1,00)^z} = (\frac{0,50}{1,00})^z = (0,5)^z$
Подставим значения скоростей:
$\frac{3,50 \cdot 10^{-4}}{1,75 \cdot 10^{-4}} = 2$
Получаем уравнение: $2 = (0,5)^z$.
Поскольку $0,5 = \frac{1}{2} = 2^{-1}$, уравнение можно переписать как $2^1 = (2^{-1})^z = 2^{-z}$.
Приравнивая показатели степени, получаем $1 = -z$, откуда $z = -1$.
Таким образом, порядок реакции по иону $OH⁻$ равен -1. Отрицательный порядок означает, что гидроксид-ионы являются ингибитором реакции.
Итак, мы определили все порядки. Кинетическое уравнение реакции имеет вид: $r = k \frac{[I⁻][OCl⁻]}{[OH⁻]}$
Ответ: порядок реакции по иону $I⁻$ равен 1; порядок реакции по иону $OCl⁻$ равен 1; порядок реакции по иону $OH⁻$ равен -1.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 250 расположенного на странице 332 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №250 (с. 332), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















