Номер 2, страница 172 - гдз по физике 10 класс учебник Мякишев, Буховцев

Авторы: Мякишев Г. Я., Буховцев Б. Б., Сотский Н. Н.
Тип: Учебник
Серия: классический курс
Издательство: Просвещение
Год издания: 2019 - 2026
Уровень обучения: базовый и углублённый
Цвет обложки: синий
ISBN: 978-5-09-103619-9
Популярные ГДЗ в 10 классе
Глава 6. Равновесие абсолютно твердых тел. Параграф 52. Примеры решения задач по теме «Равновесие твёрдых тел». Повторите материал главы 6 по следующему плану - номер 2, страница 172.
№2 (с. 172)
Условие. №2 (с. 172)
Решение. №2 (с. 172)
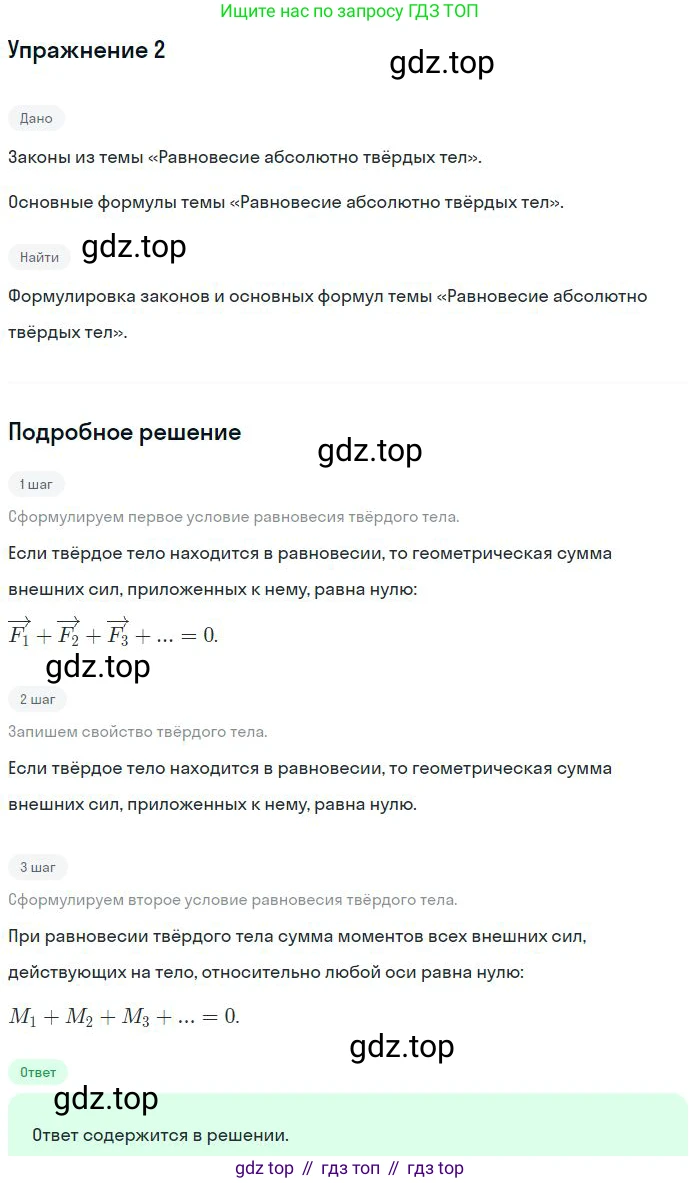
Решение 3. №2 (с. 172)
Нулевой закон термодинамики (нулевое начало термодинамики)
Формулировка: Если две термодинамические системы находятся в состоянии теплового равновесия с третьей системой, то они находятся в состоянии теплового равновесия и между собой. Этот закон вводит понятие температуры как параметра состояния, одинакового для всех систем, находящихся в равновесии друг с другом.
Смысл закона: Если система A находится в тепловом равновесии с системой C ($T_A = T_C$) и система B находится в тепловом равновесии с системой C ($T_B = T_C$), то системы A и B также находятся в тепловом равновесии друг с другом ($T_A = T_B$).
Ответ: Нулевой закон термодинамики утверждает, что если два тела находятся в тепловом равновесии с третьим, то они находятся в тепловом равновесии друг с другом, что является основой для введения понятия температуры.
Первый закон термодинамики (первое начало термодинамики)
Формулировка: Количество теплоты $Q$, сообщенное системе, идет на изменение ее внутренней энергии $\Delta U$ и на совершение системой работы $A$ над внешними силами. Данный закон представляет собой закон сохранения энергии для термодинамических процессов.
Основная формула:
$Q = \Delta U + A$
где $Q$ — количество теплоты, полученное системой от окружающей среды, $\Delta U$ — изменение внутренней энергии системы, $A$ — работа, совершенная системой над внешними телами.
Для бесконечно малого процесса закон записывается в дифференциальной форме:
$\delta Q = dU + \delta A$
Ответ: Первый закон термодинамики является законом сохранения энергии, согласно которому теплота, подведенная к системе, расходуется на изменение ее внутренней энергии и на совершение работы системой. Основная формула: $Q = \Delta U + A$.
Второй закон термодинамики (второе начало термодинамики)
Формулировка: Этот закон указывает на направление протекания самопроизвольных термодинамических процессов и имеет несколько эквивалентных формулировок.
Формулировка Р. Клаузиуса: Невозможен процесс, единственным результатом которого является передача тепла от холодного тела к горячему.
Формулировка У. Томсона (Кельвина): Невозможен циклический процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара.
Основная формула: Второй закон вводит понятие энтропии $S$ как функции состояния системы. В изолированных системах энтропия не может убывать:
$\Delta S \ge 0$
Изменение энтропии в обратимом процессе определяется как отношение полученного количества теплоты к абсолютной температуре:
$dS = \frac{\delta Q}{T}$
Следствием второго закона является то, что коэффициент полезного действия (КПД) любой тепловой машины не может превышать КПД идеальной машины Карно, работающей при тех же температурах нагревателя ($T_H$) и холодильника ($T_X$):
$\eta \le 1 - \frac{T_X}{T_H}$
Ответ: Второй закон термодинамики определяет направление термодинамических процессов, утверждая, что энтропия изолированной системы не убывает ($\Delta S \ge 0$), и накладывает ограничения на преобразование теплоты в работу.
Третий закон термодинамики (третье начало термодинамики, или теорема Нернста)
Формулировка: Энтропия любой равновесной системы при стремлении температуры к абсолютному нулю стремится к определенному постоянному пределу, не зависящему от других параметров состояния (давления, объема). Для совершенных кристаллов этот предел принимается равным нулю.
Основная формула:
$\lim_{T \to 0} S = 0$
Из этого закона следует, что абсолютный нуль температуры недостижим.
Ответ: Третий закон термодинамики постулирует, что энтропия системы стремится к нулю при приближении температуры к абсолютному нулю, $\lim_{T \to 0} S = 0$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по физике за 10 класс, для упражнения номер 2 расположенного на странице 172 к учебнику серии классический курс 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по физике к упражнению №2 (с. 172), авторов: Мякишев (Генадий Яковлевич), Буховцев (Борис Борисович), Сотский (Николай Николаевич), ФГОС (старый) базовый и углублённый уровень обучения учебного пособия издательства Просвещение.




















