Номер 51, страница 294 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 11. Теоретическое описание химических реакций. 11.1. Тепловые эффекты химических реакций. Уровень 2 - номер 51, страница 294.
№51 (с. 294)
Условие. №51 (с. 294)
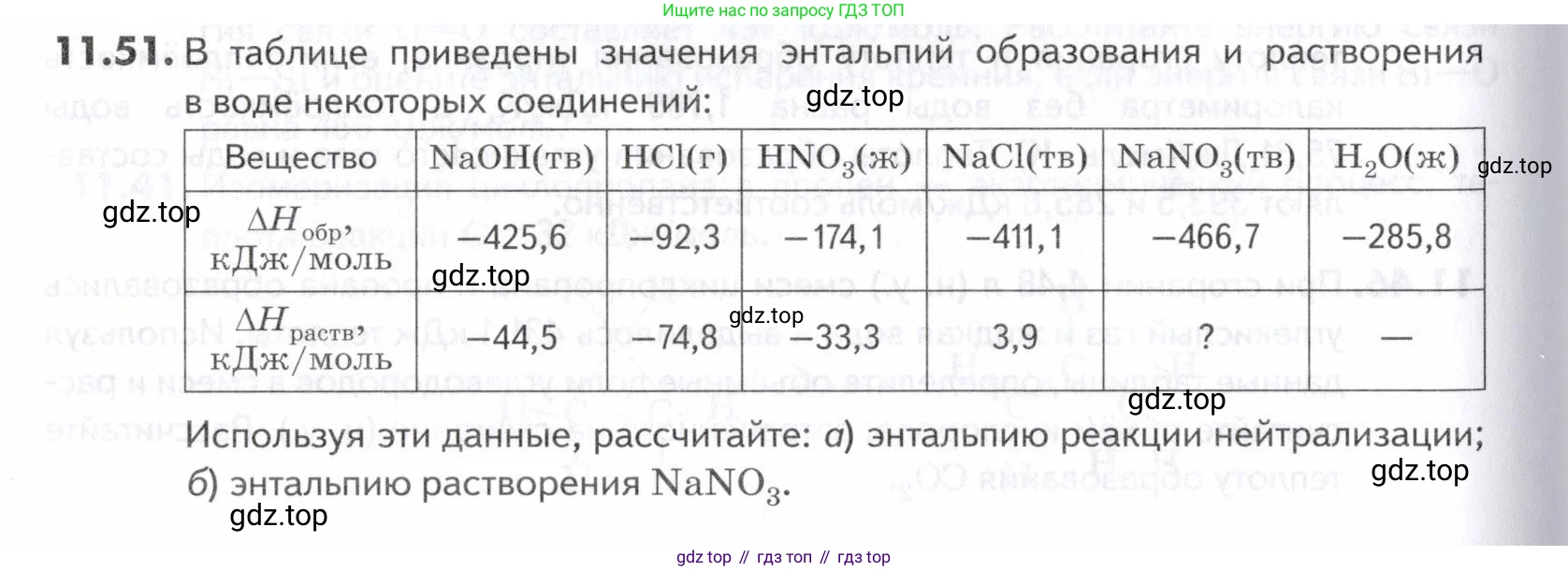
11.51. В таблице приведены значения энтальпий образования и растворения в воде некоторых соединений:
| Вещество | NaOH(тв) | HCl(г) | NaCl(тв) | |||
| кДж/моль | -425,6 | -92,3 | -174,1 | -411,1 | -466,7 | -285,8 |
| кДж/моль | -44,5 | -74,8 | -33,3 | 3,9 | ? | — |
Используя эти данные, рассчитайте: а) энтальпию реакции нейтрализации; б) энтальпию растворения
Решение 3. №51 (с. 294)
Дано:
$\Delta H_{обр, NaOH(тв)} = -425,6$ кДж/моль
$\Delta H_{раств, NaOH} = -44,5$ кДж/моль
$\Delta H_{обр, HCl(г)} = -92,3$ кДж/моль
$\Delta H_{раств, HCl} = -74,8$ кДж/моль
$\Delta H_{обр, HNO_3(ж)} = -174,1$ кДж/моль
$\Delta H_{раств, HNO_3} = -33,3$ кДж/моль
$\Delta H_{обр, NaCl(тв)} = -411,1$ кДж/моль
$\Delta H_{раств, NaCl} = 3,9$ кДж/моль
$\Delta H_{обр, NaNO_3(тв)} = -466,7$ кДж/моль
$\Delta H_{обр, H_2O(ж)} = -285,8$ кДж/моль
Найти:
а) $\Delta H_{нейтр}$ - энтальпию реакции нейтрализации
б) $\Delta H_{раств, NaNO_3}$ - энтальпию растворения NaNO₃
Решение:
а) энтальпию реакции нейтрализации
Реакция нейтрализации сильной кислоты сильным основанием в водном растворе описывается ионным уравнением $H^+_{(aq)} + OH^-_{(aq)} \rightarrow H_2O_{(l)}$. Рассчитаем ее энтальпию на примере реакции гидроксида натрия и соляной кислоты, для которых есть все данные:
$NaOH_{(aq)} + HCl_{(aq)} \rightarrow NaCl_{(aq)} + H_2O_{(l)}$
Согласно следствию из закона Гесса, энтальпия реакции ($\Delta H_{реакции}$) равна разности сумм энтальпий образования продуктов и реагентов:
$\Delta H_{нейтр} = \sum \Delta H_{обр, \text{продуктов}} - \sum \Delta H_{обр, \text{реагентов}}$
$\Delta H_{нейтр} = (\Delta H_{обр, NaCl(aq)} + \Delta H_{обр, H_2O(ж)}) - (\Delta H_{обр, NaOH(aq)} + \Delta H_{обр, HCl(aq)})$
Энтальпии образования веществ в водном растворе ($\Delta H_{обр, (aq)}$) можно рассчитать, зная энтальпию образования чистого вещества и энтальпию его растворения ($\Delta H_{раств}$):
$\Delta H_{обр, (aq)} = \Delta H_{обр, \text{чистого вещества}} + \Delta H_{раств}$
Рассчитаем необходимые значения энтальпий образования в растворе:
$\Delta H_{обр, NaOH(aq)} = \Delta H_{обр, NaOH(тв)} + \Delta H_{раств, NaOH} = -425,6 + (-44,5) = -470,1$ кДж/моль
$\Delta H_{обр, HCl(aq)} = \Delta H_{обр, HCl(г)} + \Delta H_{раств, HCl} = -92,3 + (-74,8) = -167,1$ кДж/моль
$\Delta H_{обр, NaCl(aq)} = \Delta H_{обр, NaCl(тв)} + \Delta H_{раств, NaCl} = -411,1 + 3,9 = -407,2$ кДж/моль
Энтальпия образования жидкой воды дана в таблице: $\Delta H_{обр, H_2O(ж)} = -285,8$ кДж/моль.
Теперь подставим все значения в формулу для энтальпии нейтрализации:
$\Delta H_{нейтр} = (-407,2 + (-285,8)) - (-470,1 + (-167,1)) = -693,0 - (-637,2) = -55,8$ кДж/моль
Ответ: энтальпия реакции нейтрализации равна $-55,8$ кДж/моль.
б) энтальпию растворения NaNO₃
Для нахождения энтальпии растворения нитрата натрия ($\Delta H_{раств, NaNO_3}$) воспользуемся реакцией нейтрализации гидроксида натрия азотной кислотой:
$NaOH_{(aq)} + HNO_{3(aq)} \rightarrow NaNO_{3(aq)} + H_2O_{(l)}$
Так как это тоже реакция нейтрализации сильного основания и сильной кислоты, ее энтальпия будет равна энтальпии нейтрализации, рассчитанной в пункте а): $\Delta H_{реакции} = \Delta H_{нейтр} = -55,8$ кДж/моль.
Запишем для этой реакции уравнение на основе закона Гесса:
$\Delta H_{нейтр} = (\Delta H_{обр, NaNO_3(aq)} + \Delta H_{обр, H_2O(ж)}) - (\Delta H_{обр, NaOH(aq)} + \Delta H_{обр, HNO_3(aq)})$
Из этого уравнения мы можем выразить энтальпию образования нитрата натрия в водном растворе $\Delta H_{обр, NaNO_3(aq)}$.
Предварительно рассчитаем энтальпию образования азотной кислоты в водном растворе:
$\Delta H_{обр, HNO_3(aq)} = \Delta H_{обр, HNO_3(ж)} + \Delta H_{раств, HNO_3} = -174,1 + (-33,3) = -207,4$ кДж/моль
Энтальпия образования NaOH(aq) была найдена в пункте а): $\Delta H_{обр, NaOH(aq)} = -470,1$ кДж/моль.
Выразим и рассчитаем $\Delta H_{обр, NaNO_3(aq)}$:
$-55,8 = (\Delta H_{обр, NaNO_3(aq)} + (-285,8)) - (-470,1 + (-207,4))$
$-55,8 = \Delta H_{обр, NaNO_3(aq)} - 285,8 - (-677,5)$
$-55,8 = \Delta H_{обр, NaNO_3(aq)} + 391,7$
$\Delta H_{обр, NaNO_3(aq)} = -55,8 - 391,7 = -447,5$ кДж/моль
Теперь, зная энтальпию образования $NaNO_3$ в твердом виде и в водном растворе, найдем энтальпию растворения:
$\Delta H_{раств, NaNO_3} = \Delta H_{обр, NaNO_3(aq)} - \Delta H_{обр, NaNO_3(тв)}$
$\Delta H_{раств, NaNO_3} = -447,5 - (-466,7) = -447,5 + 466,7 = 19,2$ кДж/моль
Ответ: энтальпия растворения $NaNO_3$ равна $19,2$ кДж/моль.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 51 расположенного на странице 294 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №51 (с. 294), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















