Номер 2.12, страница 39 - гдз по физике 11 класс сборник задач Заболотский, Комиссаров

Авторы: Заболотский А. А., Комиссаров В. Ф., Петрова М. А.
Тип: Сборник задач
Издательство: Дрофа
Год издания: 2020 - 2026
Цвет обложки: оранжевый изображен магнит и шары
ISBN: 978-5-358-22437-7
Популярные ГДЗ в 11 классе
Основы электродинамики. Глава 2. Электрический ток в различных средах. Электрический ток в электролитах - номер 2.12, страница 39.
№2.12 (с. 39)
Условие. №2.12 (с. 39)
скриншот условия
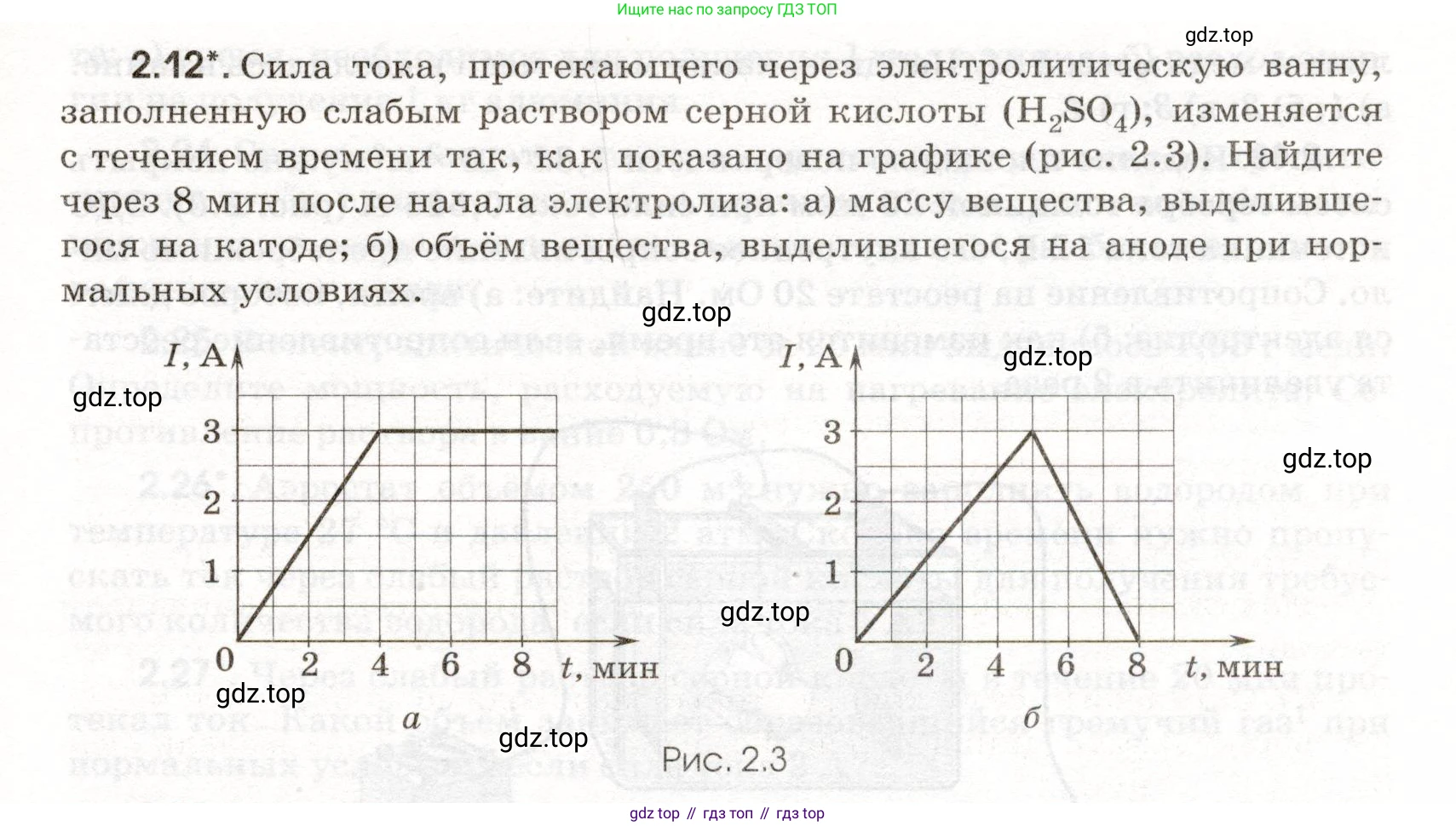
2.12*. Сила тока, протекающего через электролитическую ванну, заполненную слабым раствором серной кислоты ($\text{H}_2\text{SO}_4$), изменяется с течением времени так, как показано на графике (рис. 2.3). Найдите через 8 мин после начала электролиза:
а) массу вещества, выделившегося на катоде;
б) объём вещества, выделившегося на аноде при нормальных условиях.
Рис. 2.3
Решение. №2.12 (с. 39)
Дано:
Электролиз слабого раствора H₂SO₄
Общее время электролиза: $t_{общ} = 8 \text{ мин}$
Случай а (график а):
Сила тока линейно возрастает от $I_0 = 0 \text{ А}$ до $I_{max} = 3 \text{ А}$ за время $t_1 = 4 \text{ мин}$.
Сила тока постоянна $I = 3 \text{ А}$ в интервале времени от $t_1 = 4 \text{ мин}$ до $t_2 = 8 \text{ мин}$.
Случай б (график б):
Сила тока линейно возрастает от $I_0 = 0 \text{ А}$ до $I_{max} = 3 \text{ А}$ за время $t_1 = 5 \text{ мин}$.
Сила тока линейно убывает от $I_{max} = 3 \text{ А}$ до $I = 0 \text{ А}$ в интервале времени от $t_1 = 5 \text{ мин}$ до $t_2 = 8 \text{ мин}$.
Перевод в СИ:
$t_{общ} = 8 \text{ мин} = 8 \times 60 \text{ с} = 480 \text{ с}$
Случай а: $t_1 = 4 \text{ мин} = 240 \text{ с}$, $t_2 = 8 \text{ мин} = 480 \text{ с}$
Случай б: $t_1 = 5 \text{ мин} = 300 \text{ с}$, $t_2 = 8 \text{ мин} = 480 \text{ с}$
Справочные данные:
Молярная масса водорода (H₂): $M_H = 2 \text{ г/моль}$
Молярная масса кислорода (O₂): $M_O = 32 \text{ г/моль}$
Постоянная Фарадея: $F \approx 96500 \text{ Кл/моль}$
Число электронов для иона водорода: $z_H = 2$
Число электронов для иона кислорода: $z_O = 4$
Молярный объём газа при нормальных условиях (н.у.): $V_m = 22.4 \text{ л/моль}$
Найти:
Для каждого случая (график а и график б):
a) массу вещества, выделившегося на катоде - $m_{кат}$
б) объём вещества, выделившегося на аноде - $V_{ан}$
Решение:
При электролизе слабого водного раствора серной кислоты происходит электролиз воды. На катоде выделяется водород (H₂), а на аноде — кислород (O₂).
Реакция на катоде (восстановление): $2H_2O + 2e^- \rightarrow H_2 \uparrow + 2OH^-$
Реакция на аноде (окисление): $2H_2O - 4e^- \rightarrow O_2 \uparrow + 4H^+$
Согласно объединённому закону Фарадея, масса выделившегося вещества определяется по формуле:
$m = \frac{M}{zF} q$
где $\text{M}$ — молярная масса вещества, $\text{z}$ — количество электронов, участвующих в реакции, $\text{F}$ — постоянная Фарадея, а $\text{q}$ — электрический заряд, прошедший через электролит. Заряд $\text{q}$ численно равен площади под графиком зависимости силы тока от времени $I(t)$.
Объём выделившегося газа при нормальных условиях можно найти по формуле:
$V = n \cdot V_m$, где $\text{n}$ — количество вещества. Количество вещества можно выразить через заряд: $n = \frac{q}{zF}$. Тогда формула для объёма:
$V = \frac{q}{zF} V_m$
Рассмотрим каждый случай отдельно.
Расчеты для графика а
Найдем общий заряд $q_a$, прошедший через электролит. Он равен площади фигуры под графиком (трапеции), которую можно рассчитать как сумму площадей треугольника и прямоугольника.
$q_a = S_{треуг} + S_{прямоуг} = \frac{1}{2} \cdot (4 \cdot 60 \text{ с}) \cdot 3 \text{ А} + (8-4) \cdot 60 \text{ с} \cdot 3 \text{ А}$
$q_a = \frac{1}{2} \cdot 240 \cdot 3 + 240 \cdot 3 = 360 \text{ Кл} + 720 \text{ Кл} = 1080 \text{ Кл}$
а) массу вещества, выделившегося на катоде
На катоде выделяется водород (H₂). Его масса:
$m_{H_2} = \frac{M_H}{z_H F} q_a = \frac{2 \text{ г/моль}}{2 \cdot 96500 \text{ Кл/моль}} \cdot 1080 \text{ Кл} \approx 0.0112 \text{ г} = 11.2 \text{ мг}$
Ответ: масса выделившегося на катоде водорода составляет примерно 11.2 мг.
б) объём вещества, выделившегося на аноде при нормальных условиях
На аноде выделяется кислород (O₂). Его объём:
$V_{O_2} = \frac{q_a}{z_O F} V_m = \frac{1080 \text{ Кл}}{4 \cdot 96500 \text{ Кл/моль}} \cdot 22.4 \text{ л/моль} \approx 0.0627 \text{ л} = 62.7 \text{ мл}$
Ответ: объём выделившегося на аноде кислорода составляет примерно 62.7 мл.
Расчеты для графика б
Найдем общий заряд $q_б$, прошедший через электролит. Он равен площади треугольника под графиком.
$q_б = S_{треуг} = \frac{1}{2} \cdot \text{основание} \cdot \text{высота} = \frac{1}{2} \cdot (8 \cdot 60 \text{ с}) \cdot 3 \text{ А}$
$q_б = \frac{1}{2} \cdot 480 \cdot 3 = 720 \text{ Кл}$
а) массу вещества, выделившегося на катоде
На катоде выделяется водород (H₂). Его масса:
$m_{H_2} = \frac{M_H}{z_H F} q_б = \frac{2 \text{ г/моль}}{2 \cdot 96500 \text{ Кл/моль}} \cdot 720 \text{ Кл} \approx 0.00746 \text{ г} = 7.46 \text{ мг}$
Ответ: масса выделившегося на катоде водорода составляет примерно 7.46 мг.
б) объём вещества, выделившегося на аноде при нормальных условиях
На аноде выделяется кислород (O₂). Его объём:
$V_{O_2} = \frac{q_б}{z_O F} V_m = \frac{720 \text{ Кл}}{4 \cdot 96500 \text{ Кл/моль}} \cdot 22.4 \text{ л/моль} \approx 0.0418 \text{ л} = 41.8 \text{ мл}$
Ответ: объём выделившегося на аноде кислорода составляет примерно 41.8 мл.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по физике за 11 класс, для упражнения номер 2.12 расположенного на странице 39 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по физике к упражнению №2.12 (с. 39), авторов: Заболотский (Алексей Алексеевич), Комиссаров (Владимир Фёдорович), Петрова (Мария Арсеньевна), учебного пособия издательства Дрофа.

















