Номер 23, страница 27, часть 2 - гдз по физике 10 класс учебник Генденштейн, Булатова
Авторы: Генденштейн Л. Э., Булатова А. А., Корнильев И. Н., Кошкина А. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый и углублённый
Часть: 2
Цвет обложки: бирюзовый Изображена ракета
ISBN: 978-5-09-091731-5
Популярные ГДЗ в 10 классе
Часть 2. Молекулярная физика и термодинамика. Глава V. Молекулярная физика. Параграф 27. Уравнение состояния идеального газа - номер 23, страница 27.
№23 (с. 27)
Условие. №23 (с. 27)
скриншот условия
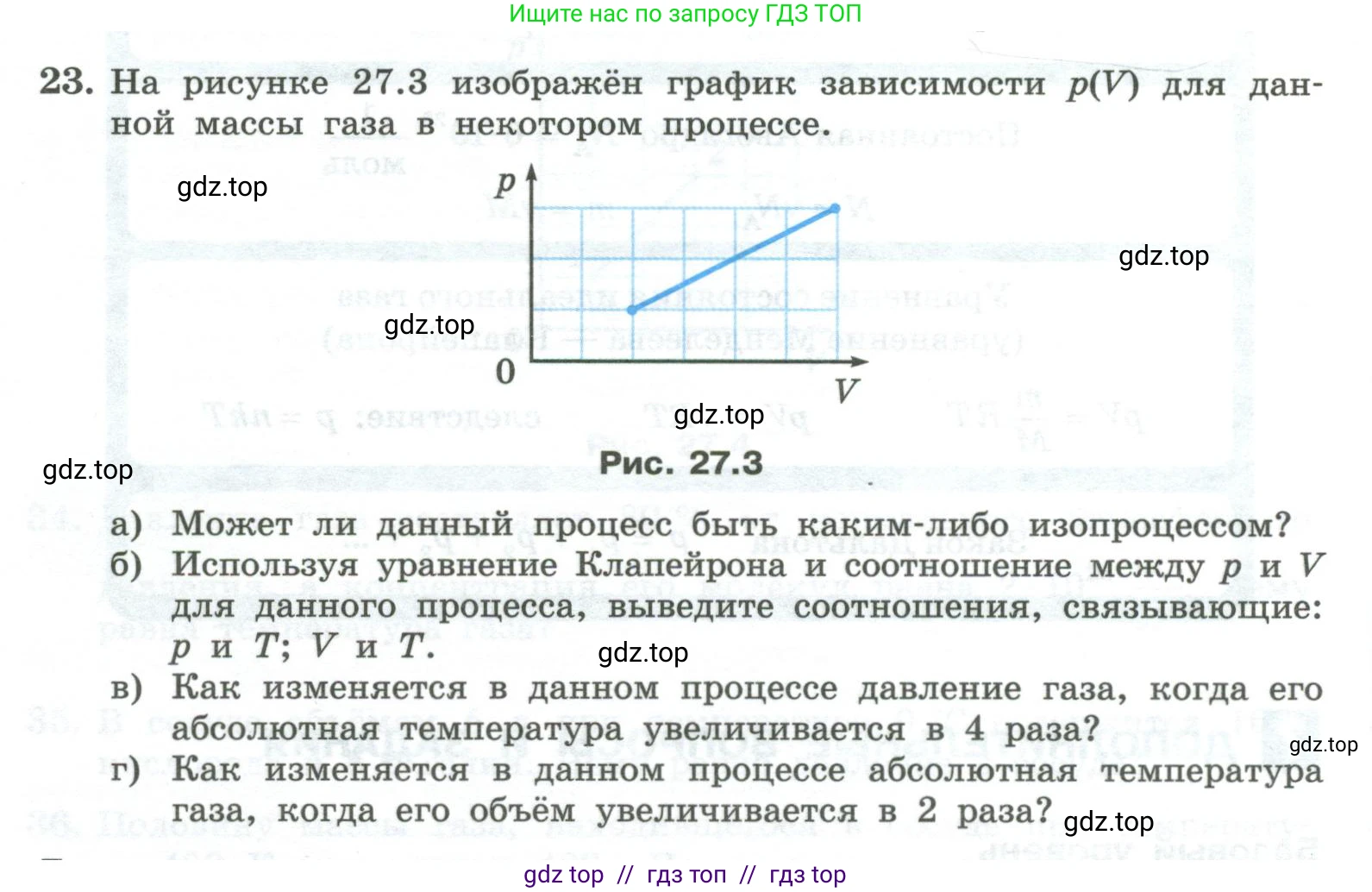
23. На рисунке 27.3 изображён график зависимости $p(V)$ для данной массы газа в некотором процессе.
Рис. 27.3
а) Может ли данный процесс быть каким-либо изопроцессом?
б) Используя уравнение Клапейрона и соотношение между $\text{p}$ и $\text{V}$ для данного процесса, выведите соотношения, связывающие: $\text{p}$ и $\text{T}$; $\text{V}$ и $\text{T}$.
в) Как изменяется в данном процессе давление газа, когда его абсолютная температура увеличивается в 4 раза?
г) Как изменяется в данном процессе абсолютная температура газа, когда его объём увеличивается в 2 раза?
Решение 2. №23 (с. 27)
Дано:
График зависимости давления от объёма $p(V)$ для идеального газа постоянной массы.
Зависимость является линейной и описывается уравнением $p = kV + b$, где $k > 0$ и $b > 0$ — константы.
Найти:
а) Может ли данный процесс быть каким-либо изопроцессом?
б) Соотношения, связывающие $\text{p}$ и $\text{T}$; $\text{V}$ и $\text{T}$.
в) Как изменяется давление $\text{p}$, когда абсолютная температура $\text{T}$ увеличивается в 4 раза?
г) Как изменяется абсолютная температура $\text{T}$, когда объём $\text{V}$ увеличивается в 2 раза?
Решение:
а) Изопроцессы — это процессы, в которых один из макроскопических параметров (давление, объем или температура) газа постоянной массы остается неизменным.
- Изобарный процесс: $p = \text{const}$. График в координатах $(V, p)$ — это прямая, параллельная оси объемов $\text{V}$.
- Изохорный процесс: $V = \text{const}$. График в координатах $(V, p)$ — это прямая, параллельная оси давлений $\text{p}$.
- Изотермический процесс: $T = \text{const}$. Согласно закону Бойля-Мариотта, $pV = \text{const}$, или $p = \frac{\text{const}}{V}$. График в координатах $(V, p)$ — это гипербола.
График, представленный на рисунке, является наклонной прямой, не проходящей через начало координат. Он не соответствует ни одному из графиков изопроцессов. Следовательно, данный процесс не является изопроцессом.
Ответ: Нет, данный процесс не является ни изобарным, ни изохорным, ни изотермическим.
б) Для вывода соотношений воспользуемся уравнением состояния идеального газа (уравнением Менделеева-Клапейрона) для постоянной массы газа и уравнением процесса, следующим из графика.
1. Уравнение состояния: $pV = \nu R T$. Так как масса газа постоянна, то и количество вещества $\nu$ постоянно. Обозначим произведение постоянных величин $\nu R$ через $\text{C}$, тогда $pV = CT$.
2. Уравнение процесса из графика: $p = kV + b$.
Найдем соотношение между p и T. Для этого исключим объем $\text{V}$ из системы уравнений. Из уравнения процесса выразим $\text{V}$: $V = \frac{p - b}{k}$. Подставим это выражение в уравнение состояния:
$p \left( \frac{p-b}{k} \right) = CT \implies p^2 - bp = kCT$.
Это квадратичное уравнение относительно $\text{p}$. Решая его, находим зависимость $\text{p}$ от $\text{T}$:
$p^2 - bp - kCT = 0 \implies p = \frac{b \pm \sqrt{b^2 - 4(1)(-kCT)}}{2} = \frac{b \pm \sqrt{b^2 + 4kCT}}{2}$.
Поскольку давление $\text{p}$ всегда положительно (и из графика видно, что $p > b > 0$), выбираем решение со знаком «+».
Итоговая зависимость: $p(T) = \frac{b + \sqrt{b^2 + 4kCT}}{2}$.
Найдем соотношение между V и T. Для этого исключим давление $\text{p}$ из системы уравнений. Подставим $p = kV + b$ в уравнение состояния:
$(kV + b)V = CT \implies kV^2 + bV - CT = 0$.
Это квадратичное уравнение относительно $\text{V}$. Решая его, находим зависимость $\text{V}$ от $\text{T}$:
$V = \frac{-b \pm \sqrt{b^2 - 4(k)(-CT)}}{2k} = \frac{-b \pm \sqrt{b^2 + 4kCT}}{2k}$.
Поскольку объем $\text{V}$ всегда положителен, выбираем решение со знаком «+».
Итоговая зависимость: $V(T) = \frac{-b + \sqrt{b^2 + 4kCT}}{2k}$.
Ответ: Соотношения имеют вид: $p^2 - bp = kCT$ и $kV^2 + bV = CT$.
в) Пусть начальное состояние газа $(p_1, T_1)$, а конечное — $(p_2, T_2)$, причем по условию $T_2 = 4T_1$. Воспользуемся соотношением $p^2 - bp = kCT$ из пункта б).
Для начального состояния: $p_1^2 - bp_1 = kCT_1$.
Для конечного состояния: $p_2^2 - bp_2 = kCT_2 = kC(4T_1) = 4(kCT_1)$.
Подставляя выражение для $kCT_1$ из первого уравнения во второе, получаем: $p_2^2 - bp_2 = 4(p_1^2 - bp_1)$.
Отношение давлений $\frac{p_2}{p_1}$ не является постоянной величиной. Проанализируем его, используя явную зависимость $p(T)$:
$\frac{p_2}{p_1} = \frac{b + \sqrt{b^2 + 4kCT_2}}{b + \sqrt{b^2 + 4kCT_1}} = \frac{b + \sqrt{b^2 + 16kCT_1}}{b + \sqrt{b^2 + 4kCT_1}}$.
Этот множитель всегда больше 1. В предельном случае, когда процесс происходит при очень высоких температурах (или если бы $b=0$), зависимость $\text{p}$ от $\text{T}$ была бы $p \propto \sqrt{T}$. В этом случае давление увеличилось бы в $\sqrt{4} = 2$ раза. Поскольку $b>0$, можно показать, что множитель всегда меньше 2.
Ответ: Давление увеличится, но менее чем в 2 раза. Коэффициент увеличения зависит от начального состояния газа.
г) Пусть начальное состояние газа $(V_1, T_1)$, а конечное — $(V_2, T_2)$, причем по условию $V_2 = 2V_1$. Воспользуемся соотношением $kV^2 + bV = CT$ из пункта б), или $T = \frac{V(kV+b)}{C}$.
Для начального состояния: $T_1 = \frac{V_1(kV_1+b)}{C}$.
Для конечного состояния: $T_2 = \frac{V_2(kV_2+b)}{C} = \frac{2V_1(k(2V_1)+b)}{C} = \frac{2V_1(2kV_1+b)}{C}$.
Найдем отношение температур:
$\frac{T_2}{T_1} = \frac{\frac{2V_1(2kV_1+b)}{C}}{\frac{V_1(kV_1+b)}{C}} = \frac{2(2kV_1+b)}{kV_1+b} = \frac{4kV_1+2b}{kV_1+b}$.
Этот множитель зависит от начального объема $V_1$. Проанализируем его предельные значения.
- При очень больших начальных объемах ($V_1 \to \infty$), слагаемым $\text{b}$ можно пренебречь. Тогда $\frac{T_2}{T_1} \approx \frac{4kV_1}{kV_1} = 4$.
- Если бы процесс начинался при очень малом объеме ($V_1 \to 0$), то $\frac{T_2}{T_1} \approx \frac{2b}{b} = 2$.
Поскольку в реальном процессе $V_1 > 0$ и конечно, то значение множителя будет находиться в интервале $(2, 4)$.
Ответ: Абсолютная температура увеличится более чем в 2 раза, но менее чем в 4 раза. Точный коэффициент увеличения зависит от начального состояния газа.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по физике за 10 класс, для упражнения номер 23 расположенного на странице 27 для 2-й части к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по физике к упражнению №23 (с. 27), авторов: Генденштейн (Лев Элевич), Булатова (Альбина Александрова), Корнильев (Игорь Николаевич), Кошкина (Анжелика Васильевна), 2-й части ФГОС (старый) базовый и углублённый уровень обучения учебного пособия издательства Просвещение.




















