Номер 891, страница 118 - гдз по физике 10-11 класс задачник Рымкевич

Авторы: Рымкевич А. П.
Тип: Задачник
Издательство: Просвещение, Дрофа
Год издания: 2016 - 2025
Цвет обложки: белый, синий
ISBN: 978-5-358-15963-1
Популярные ГДЗ в 10 классе
Электродинамика. Глава X. Электрический ток в различных средах. 41. Электрический ток в растворах и расплавах электролитов. Электрический ток в газах - номер 891, страница 118.
№891 (с. 118)
Условие. №891 (с. 118)
скриншот условия

891. Последовательно с электролитической ванной, заполненной солью никеля, включена ванна, в которой находится соль хрома. После размыкания цепи в первой ванне выделилось 10 г никеля. Сколько хрома выделилось во второй ванне?
Решение 1. №891 (с. 118)

Решение 2. №891 (с. 118)
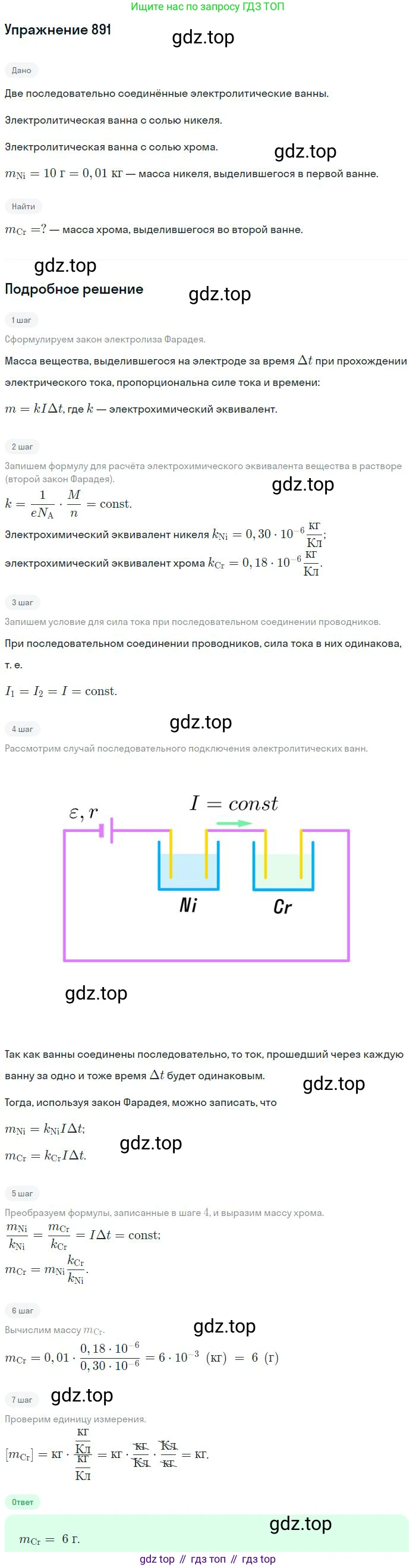
Решение 3. №891 (с. 118)

Решение 4. №891 (с. 118)
Дано:
Масса выделившегося никеля, $m_{Ni} = 10$ г
Для решения задачи также используются справочные данные:
Молярная масса никеля, $M_{Ni} \approx 59$ г/моль
Молярная масса хрома, $M_{Cr} \approx 52$ г/моль
Валентность никеля в солях, $n_{Ni} = 2$
Валентность хрома в солях, $n_{Cr} = 3$
Перевод в СИ:
$m_{Ni} = 0.01$ кг
$M_{Ni} \approx 59 \times 10^{-3}$ кг/моль
$M_{Cr} \approx 52 \times 10^{-3}$ кг/моль
Найти:
Массу выделившегося хрома, $m_{Cr}$ — ?
Решение:
Для решения задачи воспользуемся объединенным законом Фарадея для электролиза. Согласно этому закону, масса вещества ($m$), выделившегося на электроде, прямо пропорциональна заряду ($Q$), прошедшему через электролит, и электрохимическому эквиваленту вещества ($k$):
$m = k \cdot Q$
Электрохимический эквивалент, в свою очередь, равен отношению молярной массы вещества ($M$) к произведению его валентности ($n$) и постоянной Фарадея ($F$):
$k = \frac{M}{nF}$
Таким образом, формула для массы приобретает вид:
$m = \frac{M}{nF}Q$
По условию задачи, две электролитические ванны соединены последовательно. Это означает, что через них за одно и то же время протекает один и тот же электрический заряд $Q$. Запишем закон Фарадея для никеля и хрома:
$m_{Ni} = \frac{M_{Ni}}{n_{Ni}F}Q$
$m_{Cr} = \frac{M_{Cr}}{n_{Cr}F}Q$
Разделим второе уравнение на первое. При этом заряд $Q$ и постоянная Фарадея $F$ сократятся:
$\frac{m_{Cr}}{m_{Ni}} = \frac{k_{Cr}}{k_{Ni}} = \frac{M_{Cr}/n_{Cr}}{M_{Ni}/n_{Ni}}$
Это соотношение является математическим выражением второго закона Фарадея. Из него выразим искомую массу хрома $m_{Cr}$:
$m_{Cr} = m_{Ni} \cdot \frac{M_{Cr}}{M_{Ni}} \cdot \frac{n_{Ni}}{n_{Cr}}$
Подставим числовые значения. Валентность никеля в его солях, как правило, равна 2 (ионы $Ni^{2+}$), а хрома — 3 (ионы $Cr^{3+}$), что является наиболее распространенным случаем. Для удобства будем производить вычисления в граммах.
$m_{Cr} = 10 \text{ г} \cdot \frac{52 \text{ г/моль}}{59 \text{ г/моль}} \cdot \frac{2}{3} \approx 10 \cdot 0.8813 \cdot 0.6667 \approx 5.876$ г
Округлим результат до сотых.
Ответ: во второй ванне выделилось 5,88 г хрома.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по физике за 10-11 класс, для упражнения номер 891 расположенного на странице 118 к задачнику 2016 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по физике к упражнению №891 (с. 118), автора: Рымкевич (Андрей Павлович), ФГОС (старый) учебного пособия издательства Просвещение, Дрофа.



















